
A.饱和H2S溶液?
B.Ca(HCO3)2稀溶液?
C.Na2SO4稀溶液?
D.饱和CaCl2溶液?
科目:高中化学 来源: 题型:
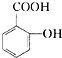
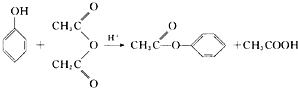
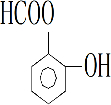 、
、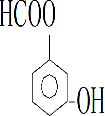 、
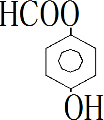
、
 、
、 、
、
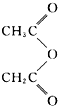 合成阿司匹林,则阿司匹林的结构为
合成阿司匹林,则阿司匹林的结构为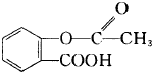

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
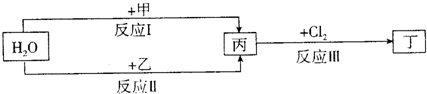
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:江苏省盐城上冈高级中学2007高三第二次阶段考试、化学试题 题型:022
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com