
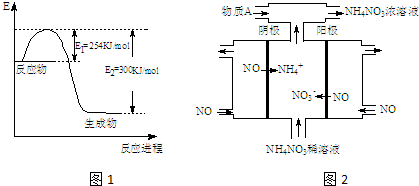
分析 (1)据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
(2)根据反应热等于反应物的总键能减去生成物的总键能计算;
(3)依据盖斯定律:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g),反应热与化学计量数成正比;
(4)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,依据电解方程式判断解答.
解答 解:(1)据焓变等于反应物活化能减去生成物活化能求算焓变,N2和H2反应生成1mol NH3过程中的△H=254KJ/mol-300KJ/mol=-46KJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol;
(2)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943+3×435-6x=-92,x=390,
故答案为:390;
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律可知肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9 kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9 kJ/mol;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,为使电解产物全部转化为5mol NH4NO3,实际需在阴极生成3molNH4+,根据阴极反应为:NO+5e-+6H+=NH4++H2O,此时电子转移的物质的量为15mol,
故答案为:NO-3e-+2H2O=NO3-+4H+;NH3;15.
点评 本题综合考查化学反应与能量变化、书写电极反应方程式、阅读题目获取新信息能力等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力,注意物质的总能量、键能与反应热的计算关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
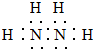 ,其中氮的化合价为-2价.
,其中氮的化合价为-2价.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.26mol | B. | 0.28 mol | C. | 0.30 mol | D. | 0.32 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| B. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 实验室如果没有四氯化碳,可以用酒精代替 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com