
(15分) 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为
__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。

(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(15分)
(1)sp3 (2分)Na<Cl<F (2分) HF和H2O分子之间能形成氢键(3分)
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1 (2分) 2∶1 (2分)
(3)TiN>MgO>CaO>KCl (2分)
(4)CrO2 (2分)
【解析】
试题分析:A、B、C、D、E都是元素周期表中的前四周期元素,A原子的p轨道半充满,外围电子排布为nS2nP3,处于ⅤA族,形成的氢化物的沸点是同主族非金属元素氢化物中最高的,则A为N元素;D原子得到一个电子后3p轨道全充满,原子的电子排布式应为1S22S22P63S23P5,为Cl元素;B+比D原子形成的离子少一个电子层,则B应为Na元素;C与B形成BC型离子化合物,则C应为第Ⅶ主族元素,根据原子序数A<C<B<D<E可知C为F元素;E的原子序数为29,为Cu元素。
(1)元素A简单氢化物是NH3, N原子形成3个σ键,还有1对孤对电子,所以其杂化方式为)sp3;根据同周期随原子序数递增电负性增大,同主族自上而下电负性减小,可得电负性顺序为:Na<Cl<F;F原子半径小而电负性大,所以HF和H2O分子之间能形成氢键,因此HF易溶于水。
(2)根据能量最低原理书写核外电子排布式为:1S22S22P63S23d104S1或〔Ar〕3d104S1;用均摊法计算图a和b中的Cu原子,面心立方堆积的晶胞含Cu原子数目:8×1/8+6×1/2=4,体心立方堆积的晶胞含Cu原子数目:8×1/8+1=2,所以面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1。
(3)晶格能越大熔点越高,所以4种离子晶体熔点从高到低的顺序是:TiN>MgO>CaO>KCl
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电子,所以适合作录音带磁粉原料的是CrO2。
考点:本题考查元素的推断、杂化方式、电负性、氢键、晶胞的计算、熔点的比较、未成对电子的判断。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:简答题
(8分)将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
现有乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为a,则碳的质量分数是( )
A. 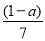 B.
B.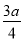 C.
C.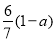 D.
D.
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列是氧化还原反应也是吸热反应的是( )
A、 灼热的炭与二氧化碳反应 B、 铁和稀硫酸的反应
C、 氢氧化钡晶体的粉末和氯化铵晶体混合 D、钢铁制品生锈的反应
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:选择题
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是
A.通入CH3OH的电极为负极
B.随着放电的进行,负极附近pH上升
C.每消耗1molCH3OH可以向外电路提供6mol e-
D.通入O2的一极电极反应为 4H2O + 2O2 - 8e- = 8OH-。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三四月月考化学试卷(解析版) 题型:填空题
(15分)用作软质隐形眼镜材料的聚合物E是:
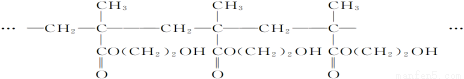
一种合成聚合物E的路线如下:
A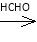
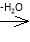

已知: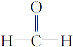 +R—CH2—CHO―→
+R—CH2—CHO―→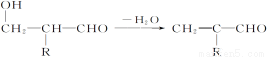
回答下列问题:
(1)A能与新制Cu(OH)2反应产生砖红色沉淀,A的结构简式是__________;
(2)D中含有的官能团名称为__________________;
(3)D→E的反应类型是____________反应;
(4)C有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有________种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1∶1∶1∶3的同分异构体的结构简式__________;
(5)写出由乙烯合成乙二醇的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:填空题
(11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
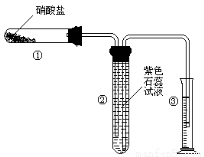
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3 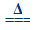 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3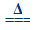 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是 ,并说明理由: 。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律: 。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省高一第二学期期末化学试卷(解析版) 题型:选择题
把下列四种X的溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
A.10 mL 2 mol·L-1 B.20 mL 2 mol·L-1 C.10 mL 4 mol·L-1 D.20 mL 3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com