
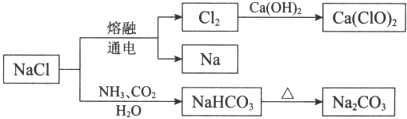
| A. | NaHCO3的热稳定性好 | |
| B. | 如图所示转化涉及的反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
分析 A、由图可知碳酸氢钠受热分解生成碳酸钠;
B、氯化钠、氨气、二氧化碳和水生成碳酸氢钠,以及碳酸氢钠受热分解是非氧化还原反应;
C、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D、结合反应方程式化合价的变化判断.
解答 解:A、由图可知碳酸氢钠受热分解生成碳酸钠,所以碳酸氢钠不稳定,故A错误;
B、氯化钠、氨气、二氧化碳和水生成碳酸氢钠,以及碳酸氢钠受热分解是非氧化还原反应,并不是全部是氧化还原反应,故B错误;
C、3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,而不是不反应,故C错误;
D、2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,Cl元素的化合价既升高又降低,所以Cl2既是氧化剂,又是还原剂,故D正确;
故选D.
点评 本题考查了盐的溶解性、氧化还原反应、氧化剂还原剂等问题,是小型综合题;氧化还原反应、氧化剂还原剂根据化合价的变化判断即可.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.
(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H3PO4>H3AsO4 | |
| B. | 氧化性:HClO4>HClO | |
| C. | 还原性:Na2S>Na2SO3 | |
| D. | 结合H+能力:OH->CO${\;}_{3}^{2-}$>HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com