
分析 A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大.A、C原子2p能级上均有两个未成对电子,外围电子排布分别为2s22p2、2s22p4,则A为碳元素,C为O元素,B的原子序数介于碳、氧之间,则B为N元素;D基态原子有11种运动状态的电子,则D为Na;F是第四周期未成对电子最多的原子,外围电子排布式为3d54s1,则F为Cr;EO2与NO2-为等电子体,结合原子序数可知E为S元素.
解答 解:A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大.A、C原子2p能级上均有两个未成对电子,外围电子排布分别为2s22p2、2s22p4,则A为碳元素,C为O元素,B的原子序数介于碳、氧之间,则B为N元素;D基态原子有11种运动状态的电子,则D为Na;F是第四周期未成对电子最多的原子,外围电子排布式为3d54s1,则F为Cr;EO2与NO2-为等电子体,结合原子序数可知E为S元素.
(1)非金属性越强,第一电离能越大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素,故上述元素中第一电离能最大的是N;A为碳元素,基态原子的电子排布式是1s22s22p2,E为S元素,在周期表中的位置是第三周期VIA族,
故答案为:N;1s22s22p2;三、VIA;
(2)科学家成功地在高压下将CO2转化为具有空间立体网状结构的晶体,属于原子晶体,与二氧化硅晶体结构类似,该晶体中C原子形成4个键,没有孤对电子,碳原子杂化轨道类型是sp3,
故答案为:sp3;
(3)Na+、CN-、Cr6+三种离子组成的化合物Na3Cr(CN)6,其中化学键的类型有离子键、配位键、共价键,该化合物中存在一个复杂离子,该离子的化学式为:[Cr(CN)6]3-,
故答案为:离子键、配位键、共价键;[Cr(CN)6]3-;
(4)“酒精检测仪”中有红色CrO3和少量H2SO4,检测酒驾时反应的化学方程式为:C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O,
故答案为:C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
点评 本题元素推断为载体,考查核外电子排布、电离能、结构与位置关系、晶体结构、杂化方式、配合物、陌生方程式书写等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力.


科目:高中化学 来源: 题型:实验题
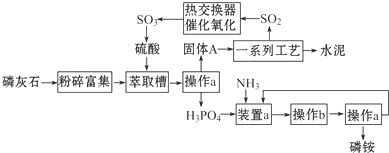
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
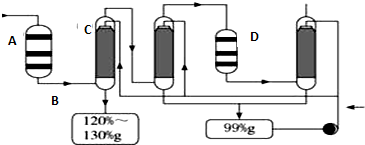
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
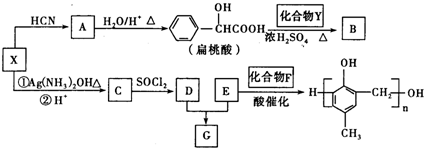
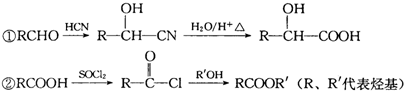
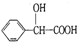
 .
.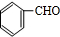 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +
+ .
. 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 .
.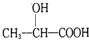 )的路线(其它试剂任选).
)的路线(其它试剂任选).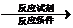 B…$→_{反应条件}^{反应试剂}$目标产物)
B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
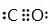 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
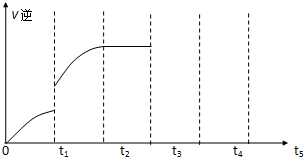
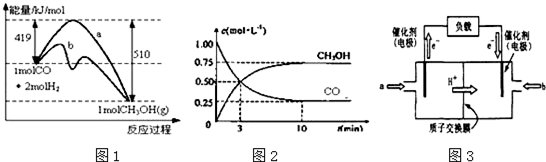
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米碳管是一种无机化合物 | |
| B. | 0.12g纳米碳管中含有6.02×l022个碳原子 | |
| C. | 纳米碳管与石墨互为同位素 | |
| D. | 纳米碳管中碳原子间以共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{28}$<M<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<M<$\frac{1}{22.4}$ | C. | $\frac{1}{39.2}$<M<$\frac{1}{28}$ | D. | 0<M<$\frac{1}{22.4}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com