
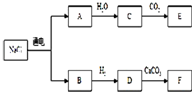
 目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl(熔融)
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl(熔融)
| ||
. |


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:福建省四地六校联考2010-2011学年高一第三次月考化学试题 题型:022
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:
2NaCl(熔融)![]() Cl2↑+2Na
Cl2↑+2Na
(1)写出A、D、F的化学式.
A________;D________;F________;
(2)写出下列化学方程式:
C+D→NaCl:________
E+F→NaCl:________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
(8分)水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)下列项目:色度、浊度、pH、某些金属离子、氯离子、硫酸根离子、氮和磷的化合物、 、生化需氧量等都是评价水质需要检测的项目,其中生化需氧量主要是检测水体中 (填“哪类物质”)消耗氧气的量。
(2)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
|
C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(3)下图是某市污水处理的工艺流程示意图:

① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(4)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 = KOCN + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→ 口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
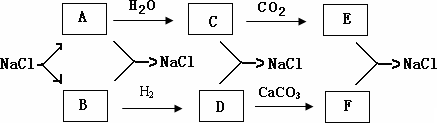
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:
2NaCl (熔融)====Cl2↑+ 2Na。现有如下转化关系:

(1)写出A、D、F的化学式。
A D E
(2)写出下列化学方程式:
C+D→NaCl:
E+F→NaCl:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com