
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,A单质试自然界中密度最小的气体,则A为H元素;B、C和E在周期表中相邻,且C、E同主族,所以B、C、E在周期表中的位置关系为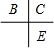 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,则D为Na;B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,故B为N元素,C为O元素,E为S元素,A和C可形成化合物H2O、H2O2.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,则D为Na;B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,故B为N元素,C为O元素,E为S元素,A和C可形成化合物H2O、H2O2.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,A单质试自然界中密度最小的气体,则A为H元素;B、C和E在周期表中相邻,且C、E同主族,所以B、C、E在周期表中的位置关系为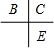 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,则D为Na;B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,故B为N元素,C为O元素,E为S元素,A和C可形成化合物H2O、H2O2.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,则D为Na;B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,故B为N元素,C为O元素,E为S元素,A和C可形成化合物H2O、H2O2.
(1)由上述分析可知,A元素的名称是:氢,D为Na,在周期表中的位置:第三周期IA族,E的离子结构示意图为 ,
,
故答案为:氢;第三周期IA族; ;
;
(2)N2分子的电子式: ,H2O的结构式:H-O-H,
,H2O的结构式:H-O-H,
故答案为: ;H-O-H;
;H-O-H;
(3)用电子式表示Na2S化合物的形成过程为: ,
,
故答案为: ;
;
(4)A元素最简单的有机化合物为CH4,与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,反应生成Cu、二氧化碳与水,反应化学方程式为:CH4+4CuO$\frac{\underline{\;高温\;}}{\;}$4Cu+CO2+2H2O,
故答案为:CH4+4CuO$\frac{\underline{\;高温\;}}{\;}$4Cu+CO2+2H2O;
(5)在100mL 18mol/L的浓H2SO4溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,随反应进行浓硫酸变为稀硫酸,稀硫酸不与Cu反应,硫酸的物质的量为0.1mol/L×18mol/L=1.8mol,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,假设浓硫酸完全反应,生成二氧化硫为0.9mol,故实际生成二氧化硫的体积小于0.9mol×22.4L/mol=20.16L,
故选:ab.
点评 本题考查位置结构性质关系及其应用,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移应用能力,(5)中注意浓硫酸与稀硫酸性质的不同,利用极限法解答.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
 )是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )
)是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )| A. | 四氯化碳 | B. | 酒精 | C. | 甲苯 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀Na0H溶液除去乙酸乙酯中的乙酸 | |
| B. | 一定条件下可以用H2除去乙烷中混有的乙烯 | |
| C. | 蒸馏时温度计的水银球应插入液面之下 | |
| D. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,即可注入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、SO42-、Cu2+、Cl- | B. | Fe2+、Na+、OH-、K+ | ||
| C. | K+、CO32-、Cl-、Ag+ | D. | H+、Cl-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
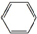 .
. ,取代反应.
,取代反应.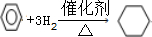 ,加成反应.
,加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
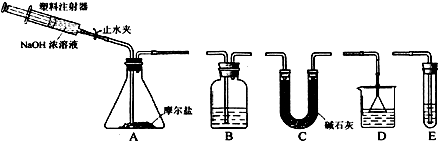
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
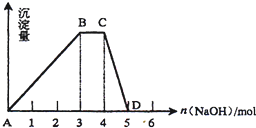
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com