

 5N2+6H2O
5N2+6H2O 5N2+6H2O£»£Ø3£©ČōDĪŖĀČ¼ī¹¤ŅµµÄÖŲŅŖ²śĘ·£¬ŌņDÓ¦ĪŖNaOH£¬½įŗĻĢāøų×Ŗ»Æ¹ŲĻµÖŖ£¬AĪŖæÉČÜŠŌĀĮŃĪ£¬BĪŖĒāŃõ»ÆĀĮ³Įµķ£¬CĪŖĘ«ĀĮĖįŃĪ£¬Ōņ·“Ó¦£Ø¢ó£©µÄĄė×Ó·½³ĢŹ½ĪŖAl3++3AlO2-+6H2O=4Al£ØOH£©3”ż£»£Ø4£©ČōDĪŖĖį»ņĖįŠŌĘųĢ壬AÄÜÓėĖįŠŌĘųĢå·“Ó¦Éś³ÉĮ½ÖÖ²»Ķ¬µÄ»ÆŗĻĪļ£¬ŌņA”¢B”¢C”¢DæÉŅŌNaOH”¢Na2CO3”¢NaHCO3”¢CO2»ņNaOH”¢Na2SO3”¢NaHSO3”¢SO2»ņFe”¢Fe£ØNO3£©2”¢Fe£ØNO3£©3£¬HNO3”£
5N2+6H2O£»£Ø3£©ČōDĪŖĀČ¼ī¹¤ŅµµÄÖŲŅŖ²śĘ·£¬ŌņDÓ¦ĪŖNaOH£¬½įŗĻĢāøų×Ŗ»Æ¹ŲĻµÖŖ£¬AĪŖæÉČÜŠŌĀĮŃĪ£¬BĪŖĒāŃõ»ÆĀĮ³Įµķ£¬CĪŖĘ«ĀĮĖįŃĪ£¬Ōņ·“Ó¦£Ø¢ó£©µÄĄė×Ó·½³ĢŹ½ĪŖAl3++3AlO2-+6H2O=4Al£ØOH£©3”ż£»£Ø4£©ČōDĪŖĖį»ņĖįŠŌĘųĢ壬AÄÜÓėĖįŠŌĘųĢå·“Ó¦Éś³ÉĮ½ÖÖ²»Ķ¬µÄ»ÆŗĻĪļ£¬ŌņA”¢B”¢C”¢DæÉŅŌNaOH”¢Na2CO3”¢NaHCO3”¢CO2»ņNaOH”¢Na2SO3”¢NaHSO3”¢SO2»ņFe”¢Fe£ØNO3£©2”¢Fe£ØNO3£©3£¬HNO3”£

 æĪĢĆČ«½ā×Ö“Ź¾ä¶ĪĘŖÕĀĻµĮŠ“š°ø
æĪĢĆČ«½ā×Ö“Ź¾ä¶ĪĘŖÕĀĻµĮŠ“š°ø ²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø
²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø µć¾¦ŠĀ½Ģ²ÄČ«Äܽā¶ĮĻµĮŠ“š°ø
µć¾¦ŠĀ½Ģ²ÄČ«Äܽā¶ĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĢśŹĒČĖĄą·¢ĻÖŗĶŹ¹ÓĆ×īŌēµÄ½šŹō |
| B£®ĢśŹĒµŲæĒÖŠŗ¬Įæ×ī¶ąµÄ½šŹōŌŖĖŲ |
| C£®“æĢśµÄČŪµć±ČÉśĢśµÄµĶ |
| D£®ĢśÄÜÓėøßĪĀĖ®ÕōĘų·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
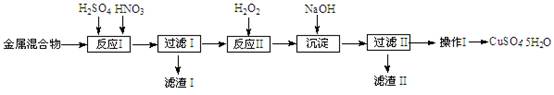
| ŃōĄė×Ó | Fe3+ | Fe2+ | Cu2+ |
| æŖŹ¼³Įµķ | 1.5 | 6.4 | 4.2 |
| ĶźČ«³Įµķ | 3.2 | 8.9 | 6.7 |
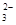 = 2I”„£«S4O
= 2I”„£«S4O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®0.24mol | B£®0.21mol | C£®0.25mol | D£®0.12mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
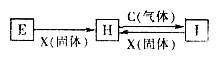
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| Ń”Ļī | ³ĀŹöI | ³ĀŹöII |
| A | NH4ClĪŖĒæĖįČõ¼īŃĪ | ÓĆ¼ÓČČ·Ø³żČ„NaClÖŠµÄNH4Cl |
| B | Fe3+¾ßÓŠŃõ»ÆŠŌ | ÓĆKSCNČÜŅŗæÉŅŌ¼ų±šFe3+ |
| C | Čܽā¶Č£ŗCaCO3<Ca(HCO3)2 | Čܽā¶Č£ŗNa2CO3<NaHCO3 |
| D | SiO2æÉÓėHF·“Ó¦ | Ēā·śĖį²»Äܱ£“ęŌŚ²£Į§ĘæÖŠ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com