
【题目】下列各组离子在无色透明的酸性溶液中能大量共存的是
A. Mg 2+、NO3、C1、K+ B. Na+、Cu2+、Cl、SO42
C. Ca2+、Na+、NO3、MnO4 D. K+ 、Cl 、Na+ 、HCO3
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=akJ·mol-1
4N2(g)+6H2O(g) △H1=akJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) △H2=bkJ·mol-1
3N2(g)+6H2O(g) △H2=bkJ·mol-1
副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H4=dkJ·mol-1
4NO(g)+6H2O(g) △H4=dkJ·mol-1
可以计算出反应2NO(g)+O2(g)![]() 2NO2(g)的△H为( )
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾是一种无色晶体,易溶于水,实验室制备KI晶体的步骤如下:
①在如图所示的三颈烧瓶中加入12.7g研细的单质碘和100mL1.5mol/L的KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3)
②碘完全反应后,打开分液漏斗中的活塞和弹簧夹1、2.向装置C中通入足量的H2S;
③反应结束后,向装置C中加入稀H2SO4酸化,水浴加热
④冷却,过滤得KI粗溶液。

(1)仪器a的名称_________;
(2)A中制取H2S气体的化学方程式___________;
(3)B装置中饱和NaHS溶液的作用是_________(填序号);
①干燥H2S气体 ②除HCl气体
(4)D中盛放的试剂是__________;
(5)步骤①中发生反应的离子方程式是_____________;
(6)由步骤④所得的KI粗溶液(含SO42-),制备KI晶体的实验方案:边搅拌边向溶液中加入足量的BaCO3,充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多固体析出,停止加热,用余热蒸干,得到KI晶体,理论上,得到KI晶体的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 | C=O | C—O | C—H | H—H | O—H |
键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO22 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 __________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是

A. d为锌块,铁片不易被腐蚀
B. d为锌块,铁片上电极反应为2H++2e-==H2↑
C. d为石墨,铁片腐蚀加快
D. d为石墨,石墨上电极反应为O2+2H2O+4e-==4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:

已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )

A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用PbS铅精矿(主要成分为PbS,含少量杂质)碳化法炼铅是一种绿色工艺,其主要工艺流程如下:

回答下列问题:
(1)“转化”是该工艺的关键,转化时发生反应的化学方程式为2PbS+2(NH4)2CO3+O2+2H2O===2PbCO3+2S+4NH3·H2O。
①(NH4)2CO3在上述反应中________(填字母)。
a.作氧化剂b.作还原剂c.既不作氧化剂也不作还原剂
②转化时,温度对铅转化率的影响如图1所示,则适宜的转化温度范围为________。
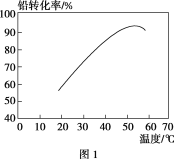
③有无FeS2对铅转化率的影响如图2所示,说明FeS2在转化中的作用是________。

(2)“溶解”时发生反应的离子方程式为________________________________。
(3)“电解”时,阴极的电极反应式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com