
 立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:
立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示: 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将FeCl3溶液加入Mg(OH)2悬浊液中 | 观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
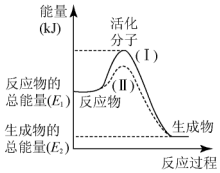 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
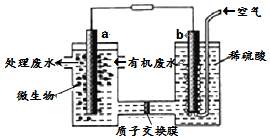 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | 电子流动方向为a→导线→b | |
| B. | H+经质子交换膜由右向左移动 | |
| C. | 放电一段是时间b极附近pH不变 | |
| D. | a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


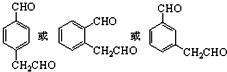 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com