
| 溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
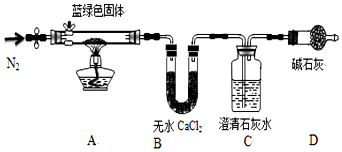
分析 (1)Na2CO3溶液中碳酸根能水解,产生氢氧根离子,所以与CuSO4溶液混合产生的蓝绿色沉淀可能为氢氧化铜;
(2)用无水乙醇洗涤悬浊液,可以洗去固体中残留的水分,乙醇具有挥发性;
(3)装置D装有碱石灰的干燥管防止空气中二氧化碳和水蒸气进入影响测定结果;
(4)加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,加热氢氧化铜时生成水蒸气和黑色氧化铜;
(5)实验验证碳酸铜或氢氧化铜是利用受热分解生成的产物性质验证,加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,加热氢氧化铜时生成水蒸气和黑色氧化铜,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分;
(6)依据图表中数据分析判断溶质溶解度和质量对实验产生的误差大小分析,Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;
(7)B中吸收的是水,C中吸收的是二氧化碳,根据质量守恒定律测得氧化铜的质量,根据原子守恒确定其化学式.
解答 解:(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,可能是反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或是碱式碳酸铜,假设1为CuCO3,假设2中沉淀为Cu(OH)2,假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3],Na2CO3溶液中碳酸根能水解,产生氢氧根离子,所以与CuSO4溶液混合产生的蓝绿色沉淀可能为氢氧化铜,
故答案为:Cu(OH)2;碳酸根水解,溶液中含有较多的OH-;
(2)所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,可以洗去固体中残留的水分,通风晾干可以让乙醇完全挥发,
故答案为:利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管所起的作用是:防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果,
故答案为:防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果;
(4)加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,加热氢氧化铜时生成水蒸气和黑色氧化铜,若反应后A中蓝绿色固体变黑,C中无明显现象证明一定不含有碳酸铜,现象的产生为氢氧化铜,假设2正确,
故答案为:假设2;
(5)实验验证碳酸铜或氢氧化铜是利用受热分解生成的产物性质验证,加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,加热氢氧化铜时生成水蒸气和黑色氧化铜,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳,
故答案为:b;
(6)Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大,
故答案为:ac;
(7)B中吸收的是水,水的物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=$\frac{19.7g}{197g/mol}$=0.1mol,氧化铜的物质的量=$\frac{27.1g-2.7g-0.1mol×44g/mol}{80g/mol}$=0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2 CuCO3•3Cu(OH)2 或 3Cu(OH)2•2 CuCO3 或 Cu5(OH)6(CO3)2,
故答案为:2 CuCO3•3Cu(OH)2 或 3Cu(OH)2•2 CuCO3 或 Cu5(OH)6(CO3)2.
点评 本题考查了探究物质的组成和含量的测定,明确物质的性质探究实验的基础,难点是化学式的确定,题目难度较大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
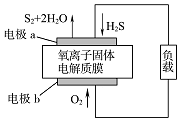 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 |  |
| A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
| B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
| C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
| D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2有氧化性,能用于雕刻电路板 | |
| B. | 金刚石是自然界中硬度最大的物质,不与氧气发生反应 | |
| C. | 明矾加入水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | SiO2不与强酸反应,可用石英器皿盛装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:H2O<H2S<H2Se | |
| B. | 降温有利于Se与H2反应生成H2Se | |
| C. | O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1 | |
| D. | 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,80gSO3的体积为22.4L | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成28g N2转移的电子数目为3NA | |
| D. | 6.0gSiO2中含有0.1NA个 SiO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H原子核内有1个中子 | B. | 它们互称为同位素 | ||
| C. | 它们是同一种原子 | D. | 它们在周期表中占一个格 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com