
| A. | 一定含有SO42- | B. | 一定同时含有Ag+和SO42- | ||
| C. | 一定含有Ag+ | D. | Ag+或SO42-至少含有一种 |
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下可将石墨转化为金刚石 | |
| B. | 绝大多数金属都能与硝酸反应,但不放出氢气 | |
| C. | 制取镁粉时,可将镁蒸气在氮气中冷却 | |
| D. | SO2能使品红溶液褪色,但不能使紫色石蕊溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后生成的盐只有Fe(NO3)2 | B. | 反应后生成的盐只有Fe(NO3)3 | ||
| C. | 反应后生成的盐为Fe(NO3)2和Fe(NO3)3 | D. | 以上三种情况都有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
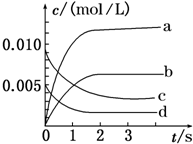 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(X)/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在醋酸溶液中加入少量NaHSO4固体,醋酸的电离平衡左移,且溶液中的c(H+)减小 | |
| B. | 将纯水加热到100℃,测得PH<7,说明升高温度可使水呈酸性 | |
| C. | 0.2mol/L的盐酸与水等体积混合,所得溶液的PH=1 | |
| D. | PH=3的稀硫酸与PH=11的氨水等体积混合,所得溶液的PH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com