
����Ŀ�������������ʣ��� NaOH ��Һ �� Һ�� ��BaCO3 ���� �� ����KHSO4�� Fe ( OH )3���� �� ͭ �� CO2 �� CH3COOH��
��1���������������ڻ�������_____������ţ����������������ڷǵ���ʵ���_____������ţ���
��2�������ʢݽ���ͨ�磬�۲쵽����������������_____�����ϴ��������ܵ������_____������ţ���
��3��д���ٺ͢��ˮ��Һ��Ӧ�����ӷ���ʽ________��
��4��д���ܵĵ��뷽��ʽ_____��
��5���������ܵ�ˮ��Һ�м��������ۣ�������Ӧ�����ӷ���ʽΪ_____��
��6���ں�0.4mol �ٵ���Һ�л���ͨ���״����6.72LCO2�����屻ȫ�����գ���Ӧ����Һ��������_____���ѧʽ����
���𰸡� �٢� �ڢ� ������ɫ���������ɫ��dz �ܢ� ![]()
![]()
![]() Na2CO3��NaHCO3
Na2CO3��NaHCO3
��������������������⿼�����ʵķ��࣬����ʺͷǵ���ʵ��жϣ����ʵ����ԭ����ĵ�Ӿ�����뷽��ʽ�����ӷ���ʽ����д�������ʵ����йصIJ�����ж���
��1����NaOH��Һ���ڻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���Һ�����ڴ�������ڷǵ���ʣ���BaCO3�������ڴ�������ڵ���ʣ�������KHSO4���ڴ�������ڵ���ʣ���Fe��OH��3�������ڻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���ͭ���ڽ������ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���CO2���ڴ�������ڷǵ��������CH3COOH���ڴ��������������������ڻ��������٢������ڷǵ���ʵ����ڢ���
��2������Fe��OH��3�����н���������ɣ���Fe��OH��3����ͨ�磬�ɹ۲쵽������ɫ���������ɫ��dz���������ڴ���������ڢۢܢޢߢ����������ƶ����������ӵ������������ɵ��ӵ���������Щ���������ܵ�������ܢ���
��3����������ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ��NaOH+CH3COOH=CH3COONa+H2O��NaOH��CH3COONa�ij����ӣ�CH3COOH��H2O�Ի�ѧʽ���������ӷ���ʽΪCH3COOH+OH-=CH3COO-+H2O��
��4��KHSO4����ǿ�����ʽ�Σ�����ʱ�ĵ��뷽��ʽΪKHSO4=K++HSO4-��
��5��KHSO4��ˮ��Һ�еĵ��뷽��ʽΪKHSO4=K++H++SO42-��KHSO4��ˮ��Һ�����ԣ���KHSO4ˮ��Һ�м�������BaCO3����Ӧ�����ӷ���ʽΪBaCO3+2H++SO42-=BaSO4+H2O+CO2����
��6��NaOH��Һ��ͨ��CO2���ܷ����ķ�Ӧ����CO2+2NaOH=Na2CO3+H2O��CO2+NaOH=NaHCO3��1:1![]() n��NaOH����n��CO2��=0.4mol��
n��NaOH����n��CO2��=0.4mol�� ![]() =4��3
=4��3![]() 2:1�����Է�Ӧ��������Һ��������Na2CO3��NaHCO3��
2:1�����Է�Ӧ��������Һ��������Na2CO3��NaHCO3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йر��Ľṹ������˵����ȷ����
A. ��������ˮ
B. �������к���̼̼˫����̼̼����
C. ����ʹ��ˮ�����Ը��������Һ��ɫ
D. ����һ���������ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ø�˹���ɿɷ���ؼ��������ͨ��ʵ��ֱ�Ӳⶨ�ķ�Ӧ�ȡ�
��֪����P4(���ף�s)��5O2(g)![]() P4O10(s) ��H��2 983.2 kJ��mol1
P4O10(s) ��H��2 983.2 kJ��mol1
��P(���ף�s)��![]() O2(g)
O2(g)![]()
![]() P4O10(s) ��H��738.5 kJ��mol1
P4O10(s) ��H��738.5 kJ��mol1
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ
A��P4(���ף�s)![]() 4P(���ף�s) ��H��29.2 kJ��mol1
4P(���ף�s) ��H��29.2 kJ��mol1
B��P4(������s)![]() 4P(������s) ��H��+29.2 kJ��mol1
4P(������s) ��H��+29.2 kJ��mol1
C��P4(������s)![]() 4P(������s) ��H��2 244.7 kJ��mol1
4P(������s) ��H��2 244.7 kJ��mol1
D��P4(������s)![]() 4P(������s) ��H��+2244.7 kJ��mol1
4P(������s) ��H��+2244.7 kJ��mol1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ����H��ʾ��ȼ��ȼ���ȵ���( )
A. CO(g)��![]() O2(g)=CO2(g) ��H����283 kJ��mol��1
O2(g)=CO2(g) ��H����283 kJ��mol��1
B. CH4(g)��2O2(g)=CO2(g)��2H2O(g) ��H����802.3 kJ��mol��1
C. 2H2(g)��O2(g)=2H2O(l) ��H����571.6 kJ��mol��1
D. H2(g)��Cl2(g)=2HCl(g) ��H����184.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA(g)��3B(g)![]() 2C(g)��2D(g) ��4�ֲ�ͬ����·�Ӧ���ʷֱ����£����з�Ӧ����v������
2C(g)��2D(g) ��4�ֲ�ͬ����·�Ӧ���ʷֱ����£����з�Ӧ����v������
A. v(A)��0.15mol/(L��min) B. v (B)��0.6 mol/(L��min)
C. v (C)��0.3 mol/(L��min) D. v (D)��0.1 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����ʵ��̽����Ӧ���ʵIJⶨ�ͱȽϡ�
��ʵ��Ŀ�ġ��ⶨп��ϡ���ᷴӦ������
��ʵ����Ʒ����ƿ��˫��������Ƥ�ܡ���Һ©����ֱ�ǵ��ܡ�50mLע����������̨�������п����1 mol/L���ᡢ4 mol/L���ᡣ
��ʵ�鲽�衿
��1��ȡһ��װ��(��ͼ��ʾ)������40 mL 1 mol/L�������п���������ռ�10 mL H2�����ʱ�䡣

��2��ȡ��һ��װ�ã�����40 mL4 mol/L�������п���������ռ�10 mL H2�����ʱ�䡣
��ʵ������п��ϡ���ᷴӦ ��д�������ռ�10mL���壬��2������ʱ��ȣ�1������ʱ��_________��
��ʵ������
�����Լ� | ��Ӧʱ�� | ��Ӧ���� |
40 mL 1 mol/L���� | �� | _________ |
40 mL 4 mol/L���� | �� | _________ |
��ʵ����ۡ�4 mol/L������п��Ӧ��1 mol/L������п��Ӧ������ ��
��ע�������1��п�Ŀ���(�������)��С ��
��2��40 mL������ҪѸ�ټ��룻
��3��װ�� ���Ҽ�ʱҪѸ��ȷ��
��4�������ռ���������ˮ����װ��(��ͼ��ʾ)���档

��ʵ�����ۡ�����ʵ��ⶨ��Ӧ���ʵķ����⣬���еķ�������(����������)��
��1�� ��
��2�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죬�ڳ����°������·������ʵ�顣
ʵ���� | ��Ӧ�� | ���� |
�� | 10 mL 2% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+����HCl��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+����NaOH��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
��1�������ܼӿ컯ѧ��Ӧ���ʵ�ԭ����__________________________��
��2��ʵ����������Ŀ����_____________________��ʵ��ʱ���ڽϳ�ʱ��û�й۲쵽������������ó����ۡ�������ʾ��ͨ��������H2O2�ȶ������ֽ⡣Ϊ�˴ﵽʵ��Ŀ�ģ����ԭʵ�鷽���ĸĽ���_____________________��
��3��д��ʵ�����Ļ�ѧ��Ӧ����ʽ��______________��
��4��ʵ�������������У�������������������ʱ��仯�Ĺ�ϵ��ͼ��������ͼ�ܹ��ó���ʵ�������____________________________��
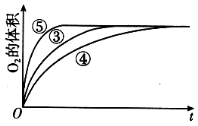
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ͼװ���Ʊ������ƣ���ѧʽΪCa3N2��������H2O��Ӧ��������˵������ȷ���� ( )

A. ����Kͨ��N2���Թ�A�������ݲ�����˵��װ������������
B. ������Ca3N2���������У��ܵõ�CaCl2��NH4Cl������
C. U�ι���ʢ�ŵĸ���������Ǽ�ʯ�ң���������Ũ����
D. ��Ӧ��������Ϩ��ƾ��ƣ�����Ӧ����ȴ�����º��ٹرջ���K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ռ���Һ���Լ�ƿ����ʹ�õ�ƿ���� �� ��
A. ������ B. ��ľ�� C. ������ D. ��Ƥ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com