

��1������ͼ�л���c(H2)��ʱ��t�ı仯����ͼ��
��2��ƽ��ʱcƽ(O2)Ϊ______________mol��L-1��
��3���������ƽ��ʱO2��Ũ�ȣ�����֪��H2O��g����CO�������ʵ����⣬������Ҫ֪��ƽ����ϵ��ij���������ƽ��Ũ�ȡ������������������H2O��CO2�������____________��
��4���������������������£�����Ϊ��ʼʱ�������г���2 mol H2��2 mol CO2������������Ӧ�ﵽƽ��ʱ��cƽ(O2)=____________mol��L-1��
��1������ͼ

��2��0.5 mol��L-1
��3��H2��CO����H2��CO2��H2O��CO��
��4��0.5 mol��L-1
���������⿼���˻�ѧƽ���֪ʶ��
��1�����ݻ�ѧ��Ӧ����ʽ�������Ϣ��
2H2O��g��![]() 2H2 + O2,
2H2 + O2,
��ʼ 2 0 0
�仯 1.25 1.25 0.625
ƽ�� 0.75 1.25 0.625
2CO + O2 ![]() 2CO2
2CO2
��ʼ 2 0.625 0
�仯 0.25 0.125 0.25
ƽ�� 1.75 0.50 0.25
�ڻ�ѧ��Ӧ�У��仯ֵ�ͻ�ѧ�����������ȣ��ɵô𰸡���1����2�����ʿ���ã���3�����ʽ��ʱ����������ʽ�У�ֻҪ֪������ͬ����O2��������������ݼ��ɣ���������������ɣ�H2��CO����H2��CO2����H2O��CO������4�������������䣬��֪����2 mol H2��2 mol CO2�ﵽ��ƽ����ԭƽ���ǵ�Чƽ�⣬���ͬ��2����


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��ѧϰ�ܱ�����ѧ���˽̿α�߶���(ѡ��4)��2009��2010ѧ�ꡡ��7�ڡ��ܵ�163�� �˽̿α��(ѡ��4) ���ͣ�022
��һ���¶Ⱥ�ѹǿ�£������¿��淴Ӧ��
2SO2(g)��O2(g)(1)�ﵽƽ��ʱ�����������Ϊ________��SO2��ת����Ϊ________��
(2)����ʼʱ����a mol��SO2��b mol��O2����a��b��2��1������ͬ�¶Ⱥ�ѹǿ�£���Ӧ�ﵽƽ��ʱ����û��������ݻ�Ϊ120 L����a��b��ֵ�ֱ�Ϊ��a��________��b��________��
(3)��Ϊ���������ܱ����������ݻ�Ϊ100 L����ʼʱ����x mol��SO2��y mol��O2��z mol��SO3����Ӧ��ƽ��ʱ���¶Ⱥ�ѹǿ��(2)��ȫ��ͬ�������ڸ�������������Ҳ��(2)��ƽ��ʱ�������ȫ��ͬ����x��yӦ������Ĺ�ϵʽΪ________��x��zӦ������Ĺ�ϵʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)��ƽ���淴Ӧ��![]()
��֪400��ʱ��1.6 mol NO��NH3������巢�����Ϸ�Ӧ�ﵽƽ������������ʵ�����Ϊ1.7 mol����������N�����ʵ���Ϊ ��
(2)��֪ij�¶���0.01 mol��L������Һ��ˮ�����c(H+)=l x 10-11mol��L����Kw= �����ڴ��¶��½�pH==a��NaOH��Һ��pH=b�����ᰴ1��100����պ���ȫ��Ӧ��a��bӦ�����ϵΪ ��
(3)��һ�ְ�ɫ���壬���ܺ���CaCO3��Ba(N O3)2��NH4 C1��KCl��A gN O3��Al2(SO4)3
��KMnO4�е�һ�ֻ��֡��ٽ���ɫ������ˮ�ܽⲢ���ˣ��ڽ������������������У�����ȫ���ܽⲢ�ų����壻������Һ�м�������ŨNaOH��Һ�����ȣ��ų���ʹʪ���ɫʯ����ֽ���������壬����Һ��ȴ��������������ϡ���ᣬ�а�ɫ������������ð�ɫ������һ���� �������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
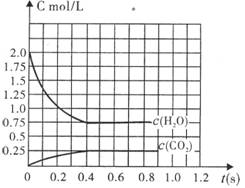 ����ȫ������淴Ӧ��2H2O(g)
����ȫ������淴Ӧ��2H2O(g) ![]() 2H2+O2��2CO+O2
2H2+O2��2CO+O2 ![]() 2CO2��˳�����е������£���2molH2O(g)��2molCO����l L�ܱ������У�ʹ�䷢����Ӧ��һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�������Ũ����ʱ��t�ı仯�������ͼ��ʾ��
2CO2��˳�����е������£���2molH2O(g)��2molCO����l L�ܱ������У�ʹ�䷢����Ӧ��һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�������Ũ����ʱ��t�ı仯�������ͼ��ʾ��
(1)����ͼ�л���c(H2)��ʱ��t�ı仯����ͼ��
(2)ƽ��ʱc(O2)ƽΪ mol��L��
(3)�������ƽ��ʱO2��Ũ�ȣ�����֪��H2O(g)
��CO�������ʵ����⣬������Ҫ֪��ƽ����
ϵ��ij���������ƽ��Ũ�ȡ������������
������H2O��CO2������� ��
(4)�������������������£�����Ϊ��ʼʱ��
 �������2molH2��2molCO2������������
�������2molH2��2molCO2������������
Ӧ�ﵽƽ��ʱ��c(O2)ƽ= mol��L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
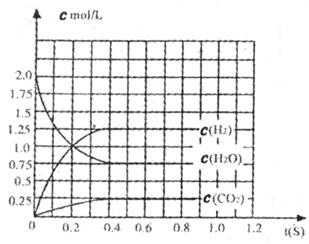
(1)����ͼ�л���c(H2)��ʱ��t�ı仯����ͼ��
(2)ƽ��ʱc(O2)ƽΪ_________mol��L��
(3)�������ƽ��ʱO2��Ũ�ȣ�����֪��H2O (g)��CO�������ʵ����⣬������Ҫ֪��ƽ����ϵ��ij���������ƽ��Ũ�ȡ������������������H2O��CO2�������(��һ���������)__________________��
(4)�������������������£�����Ϊ��ʼʱ�������г���2 mol H2��2 molCO2������������Ӧ�ﵽƽ��ʱ��c(O2)ƽ=_________mol��L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com