
| A. | 甲苯 | B. | 环戊烷 | C. | 2,2-二甲基丁烷 | D. | 对二甲苯 |
分析 烷烃在光照下与氯气反应,生成两种一氯代烃,说明该烷烃分子中有2种等效H原子,据此结合选项进行判断即可.
解答 解:A、甲苯中甲基上为1种H,与甲基处于邻、间、对位置上分别为不同的H,故一氯代物有3+1=4种,故A错误;
B、环戊烷中只有一种H,故一氯代物只有一种,故B错误;
C、2,2-二甲基丁烷的结构简式为:CH3C(CH3)2CH2CH3,其分子中含有3种等效氢原子,其一氯代物有3种,故C错误;
D、对二甲苯中甲基为一种H,剩余苯环上的H只有一种,故总共2种不同的H,故D正确,
故选D.
点评 本题考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,明确烃中等效氢原子数目的求算方法为解答本题的关键.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
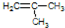 ,其系统命名为2-甲基-1-丙烯.
,其系统命名为2-甲基-1-丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

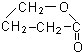 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 硫酸钠(aq) | D. | 硫酸钾(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L三氧化硫所含有的原子数目为2NA | |
| B. | 分解H2O2制O2,每生成1mol O2转移2NA个电子 | |
| C. | 62 g Na2O溶于水后所得溶液中含有O2-数为NA | |
| D. | 36.5 g HCl中含有Cl-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质 | |
| B. | 镁铝合金的熔点比镁和铝都髙 | |
| C. | 在合金中加入适量的稀土金属能大大改善其性能 | |
| D. | 青铜、硬铝、钢都是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ①③⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
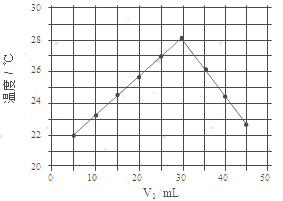 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质: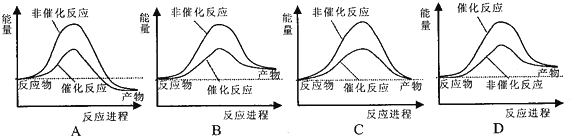
| 物质 | H-H | O=O | H-O |
| 键能/(kJ•mol-1) | 436 | 498 | 464 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com