
| A.向等体积的两溶液中分别滴入Na2CO3溶液 |
| B.向等体积的两溶液中分别加入NaOH溶液 |
| C.向等体积的两溶液中分别滴入1-2滴紫色石蕊试液 |
| D.取等体积的两种溶液,用蒸馏水分别稀释100倍,再用pH试纸测pH值 |
科目:高中化学 来源:不详 题型:填空题
 在水中的电离方程式为
在水中的电离方程式为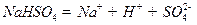 。在
。在 溶液
溶液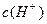 __________
__________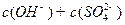 (填“>”“=”或“<”,1分)。
(填“>”“=”或“<”,1分)。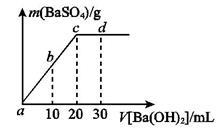
 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K 为__________(1分),在该溶液中由水电离出的
为__________(1分),在该溶液中由水电离出的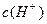 为__________mol·L-1(1分)。T℃时,将pH=11的NaOH溶液V1L与pH=1的
为__________mol·L-1(1分)。T℃时,将pH=11的NaOH溶液V1L与pH=1的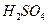 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。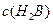 、②
、②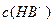 、③
、③ 由大到小的顺序为_______________(2分)。
由大到小的顺序为_______________(2分)。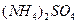 溶液、②
溶液、② 溶液、③
溶液、③ 溶液中,
溶液中,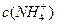 由大到小的排列顺序为_______________________(2分)。
由大到小的排列顺序为_______________________(2分)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+、H+、NO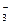 、SO 、SO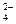 | B.Al3+、Na+、HCO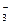 、Cl- 、Cl- |
C.H+、Cl-、SO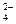 、NO 、NO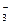 | D.CO 、NO 、NO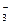 、Cl-、K+ 、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
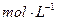 的是( )
的是( )A.25℃时,0.01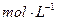 NH4Cl溶液 NH4Cl溶液 | B.25℃时,0.01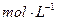 NaHSO4溶液 NaHSO4溶液 |
C.100℃时,0.01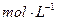 NaNO3溶液 NaNO3溶液 | D.25℃时,0.01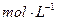 NaF溶液 NaF溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)=1×10-7mol/L的溶液 | B.pH=7的溶液 | C. c(H+)=c(OH—) |
| D.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6.9~7.1 | B.4.3~9.7 | C.3.6~10.4 | D.以上都不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从图中可以看出,水的电离是吸热过程 |
| B.若从A点到D点,可采用:温度不变 在水中加入适量的NH4Cl固体 |
| C.在处于C点状态的溶液中:Na+、Al3+、 CO32-、Cl-能够大量共存 |
| D.在处于E点状态的CH3COONa溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com