
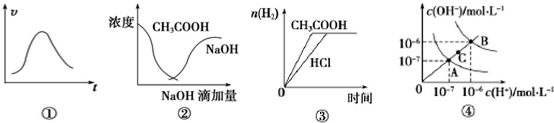
| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
分析 A.锌和稀硫酸为放热反应,结合温度、浓度对反应速率的影响判断;
B.NaOH在醋酸消耗完之前是不会在溶液中存在的,NaOH的曲线向右平移,反应完全后滴入氢氧化钠,浓度会增大;
C.醋酸为弱酸,部分电离;
D.从A点到C点,氢离子和氢氧根离子浓度都增大.
解答 解:A.锌和稀硫酸为放热反应,开始反应温度升高,速率增大,随着反应进行,浓度较小,则反应速率减小,故A正确;
B.NaOH在醋酸消耗完之前是不会在溶液中存在的,NaOH的曲线向右平移,反应完全后滴入氢氧化钠,浓度会增大,故B正确;
C.等体积、等物质的量浓度的盐酸和醋酸溶液中,盐酸溶液中的氢离子浓度大,反应速率快,达到平衡所需时间少,最后生成氢气相同,故C错误;
D.从A点到C点,氢离子和氢氧根离子浓度都增大,水的离子积常数增大,则应为升高温度,故D正确.
故选C.
点评 本题考查较为综合,为高频考点和常见题型,侧重于学生的分析能力的考查,题目涉及反应速率影响因素分析,酸碱反应浓度变化图象分析判断,弱电解质除杂电离平衡,水溶液中离子积常数随温度变化,注意相关基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | KCl(aq),HCl(aq) | B. | HNO3(aq),KNO3(aq) | C. | HCl(aq),BaCl2(aq) | D. | NaNO3(aq),HNO3(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2仅是还原产物 | |
| B. | Cu(IO3)2既是氧化剂又是还原剂 | |
| C. | 氧化产物与还原产物物质的量比为13:2 | |
| D. | 当1 mol氧化剂参加反应时,被氧化的物质的物质的量为11mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2-Cl | B. | 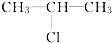 | C. | CH3CH2CH2-Br | D. | 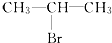 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物之间在化学性质上相似 | |
| B. | 同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化 | |
| C. | 同系物不可能是同分异构体 | |
| D. | 分子组成相差一个或几个CH2原子团的物质互称为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=6.61×10-4 |
| A. | 氰化钠溶液中通入少量CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(HCN)>c(H+)>c(OH+) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN) | |
| D. | 等体积、等浓度的NaCN和NaF溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
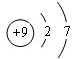 ,D离子的结构示意图:
,D离子的结构示意图: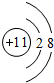 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com