
 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→
分析 (1)先写出化学方程式,注明反应物、生成物的聚集状态,依据14g N2与足量H2反应放出46kJ的热量,计算1mol氮气完全反应放出热量,据此书写该反应的热化学方程;
(2)氨气为共价化合物,用原子和物质的电子式表示形成过程;
(3)氮化钠与氯化氢反应生成氯化钠和氯化铵;
(4)反应物能量低于生成物能量的反应为吸热反应,热化学方程式中系数表示物质的量不表示微粒个数,书写热化学方程式应注明各物质的聚集状态,结合图象解答.
解答 解:(1)14g N2与足量H2反应放出46kJ的热量,则1mol氮气质量为28g,与足量H2反应放出92kJ的热量,反应的热化学方程式:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol;
(2)氨气为共价化合物,其形成过程用电子式表示为:3H•+ →
→ ,
,
故答案为:3H•+ →
→ ;
;
(3)氮化钠与氯化氢反应生成氯化钠和氯化铵两种盐,反应的方程式:Na3N+4HCl=3NaCl+NH4Cl;
故答案为:2;Na3N+4HCl=3NaCl+NH4Cl;
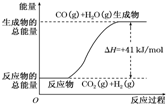
(4)从图中形式可知:CO(g)+H2O(g)═CO2(g)+H2(g)反应物能量低于生成物能量,为吸热反应,
A.反应放出的热量与反应物的物质的量成正比,反应物物质的量未知无法判断吸收的热量,故A错误;
B.热化学方程式中系数表示物质的量不表示微粒个数,故B错误;
C.反应物能量低于生成物能量的反应为吸热反应,所以该反应吸热反应,故C错误;
D.依据图象可知反应的热化学方程式表示:CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol,故D正确;
故选:ABC.
点评 本题考查了热化学方程式的书写、电子式的书写,熟悉物质的结构、明确热化学方程式含义及书写方法是解题关键,注意热化学方程式与化学方程式区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
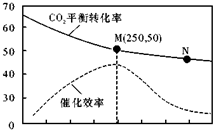 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
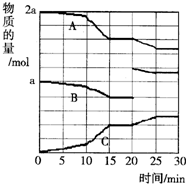
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )
某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )| A. | 该未知溶液中至少含有3种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g | |
| D. | 若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com