

 2NH3的反应热△H,进而计算生成1molNH3的反应热.
2NH3的反应热△H,进而计算生成1molNH3的反应热.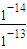 mol/L=0.1mol/L.
mol/L=0.1mol/L. .
.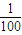 =0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,根据Kw=c(H+)?c(OH-)计算溶液中c(H+).
=0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,根据Kw=c(H+)?c(OH-)计算溶液中c(H+). 2NH3的反应热△H=946kJ?mol-1×2+3×436kJ?mol-1-6×393kJ?mol-1=-104kJ?mol-1,故生成1molNH3的△H=-104kJ?mol-1×
2NH3的反应热△H=946kJ?mol-1×2+3×436kJ?mol-1-6×393kJ?mol-1=-104kJ?mol-1,故生成1molNH3的△H=-104kJ?mol-1×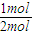 =-52kJ?mol-1.
=-52kJ?mol-1.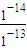 mol/L=0.1mol/L.
mol/L=0.1mol/L. ,故氢氧化钡的浓度为0.1mol/L×
,故氢氧化钡的浓度为0.1mol/L× =0.05mol/L.
=0.05mol/L.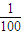 =0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,溶液中c(H+)=
=0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,溶液中c(H+)=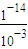 mol/L=1×10-11mol/L,故所得溶液中由水电离出c(OH-)=1×10-11mol/L.
mol/L=1×10-11mol/L,故所得溶液中由水电离出c(OH-)=1×10-11mol/L.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:阅读理解
 (1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高二上学期期末考试化学试卷 题型:填空题
(12分)(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________ kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题: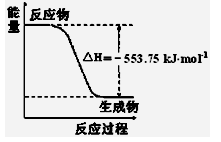
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式 。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____ ,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __ g(结果精确至0.01 g)。?
④二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 ____ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(带解析) 题型:填空题
(4分)1836年,俄国籍瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应的热化学方程式,回答问题。
已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)===NH3(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH=-52.3 kJ/mol
⑤NH4Cl(s)===NH4Cl(aq) ΔH=?
则第⑤个热化学方程式中的反应热是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com