
分析 (1)②双氧水(H2O2)是强氧化剂,在酸性条件下氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)③中使pH升高到4,不能引入新的杂质,排除AB,CuCl2不能调节pH;
(3)在pH为4~5的条件下Fe3+几乎全部水解生成Fe(OH)3,CuO过量.
解答 解:(1)双氧水(H2O2)是强氧化剂,在酸性条件下氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)③中使pH升高到4,不能引入新的杂质,排除AB,CuCl2不能调节pH,故选D,
故答案为:D;
(3)在pH为4~5的条件下Fe3+几乎全部水解生成Fe(OH)3,CuO过量,则③中过滤后滤渣的成分是Fe(OH)3与CuO,
故答案为:Fe(OH)3、CuO.
点评 本题考查较为综合,涉及氧化还原反应、CuO的与酸的反应等知识,题目难度中等,注意把握基础知识的积累.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
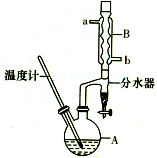 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前工业合成氨的原理是:
目前工业合成氨的原理是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com