
���� ��pH=3��������c��OH-��=c��H+�� ��ˮ���룩=$\frac{{K}_{w}}{c��{H}^{+}��}$��pH=5��NH4Cl��Һ��c��H+��Ϊ10-pH����ˮ���������c��OH-��=c��H+�� ��ˮ���룩��
��25��ʱ��ijNa2SO4��Һ��c��SO42-��=5��10-4mol•L-1��c��Na+��=1��10-3mol•L-1��ȡ����Һ1mL��ˮϡ����10mL��c��Na+��=1��10-4mol•L-1����Һ��c��H+��=1��10-7mol•L-1���ݴ˼��㣻
��ij�¶���ˮ�����ӻ�Ϊ1��10-12�����ij��ҺpH=7������Һ��c��H+��=1��10-7mol•L-1��c��OH-��=$\frac{{K}_{w}}{c��{H}^{+}��}$�����������Ӻ�����������Ũ����Դ�С�ж���Һ����ԣ�
��0.5mol•L-1��NaHSO3��Һ�е���ʯ���Һ��죬˵����Һ�����ԣ���������������ӵ���̶ȴ�����ˮ��̶ȣ���������ˮ��̶ȶ���С���ݴ��ж�����Ũ�ȴ�С��
��� �⣺��pH=3��������c��OH-��=c��H+�� ��ˮ���룩=$\frac{{K}_{w}}{c��{H}^{+}��}$=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol•L-1��pH=5��NH4Cl��Һ��c��H+��Ϊ10-pH=10-5mol•L-1����ˮ���������c��OH-��=c��H+�� ��ˮ���룩=10-5mol•L-1��
�ʴ�Ϊ��10-11��10-11��10-5��10-5��
��25��ʱ��ijNa2SO4��Һ��c��SO42-��=5��10-4mol•L-1��c��Na+��=1��10-3mol•L-1��ȡ����Һ1mL��ˮϡ����10mL��c��Na+��=1��10-4mol•L-1����Һ��c��H+��=1��10-7mol•L-1����Һ��c��H+��=1��10-7mol•L-1����c��Na+����c��OH-��=1��10-4mol•L-1��1��10-7mol•L-1=1000��
�ʴ�Ϊ��1000��
��ij�¶���ˮ�����ӻ�Ϊ1��10-12�����ij��ҺpH=7������Һ��c��H+��=1��10-7mol•L-1��c��OH-��=$\frac{{K}_{w}}{c��{H}^{+}��}$=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L��c��OH-����c��H+������Һ�ʼ��ԣ��ʴ�Ϊ�����ԣ�
��NaHSO3��Һ�����ԣ�NaHSO3��Һ�д��������������ˮ������룬ˮ�����ʼ��ԣ����뵼��������ԣ��ݴ˷���������̶ȴ���ˮ��̶ȣ�������Ũ�ȴ�СΪ��c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-�����ʴ�Ϊ��c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-����
���� ���⿼������Ũ�ȴ�С�Ƚϡ�����ˮ�⡢������ʵĵ��롢pH�����֪ʶ�㣬Ϊ��Ƶ���㣬���ؿ���ѧ�����������������ѵ��Ǽ����������ˮ����������ӻ�����������Ũ��Ũ�ȣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.816g | B�� | 0.78g | C�� | 4.66g | D�� | 5.44g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
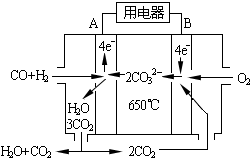 ��6����ҵ�Ͽɻ���CO��ȼ�ϣ���ͼ��MCFCȼ�ϵ�أ�������ˮú����CO��H2��Ϊȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ�AΪ��صĸ������������������д��B���缫��Ӧʽ��2CO2+O2+4e-=2CO32-��
��6����ҵ�Ͽɻ���CO��ȼ�ϣ���ͼ��MCFCȼ�ϵ�أ�������ˮú����CO��H2��Ϊȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ�AΪ��صĸ������������������д��B���缫��Ӧʽ��2CO2+O2+4e-=2CO32-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | K+��Na+��Cu2+��Al3+ |
| ������ | SO${\;}_{4}^{2-}$��HCO${\;}_{3}^{-}$��NO${\;}_{3}^{-}$��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 27% | B�� | 52% | C�� | 40% | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe�� Cl2 | B�� | Na2CO3��HCl | C�� | NaOH��CO2 | D�� | Na ��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molH2��1mol I2��ȫ��Ӧ�ų�4.5kJ���� | |
| B�� | 1������Ӻ�1���������ȫ��Ӧ�ų�9kJ���� | |
| C�� | 1molH2��1mol I2��ȫ��Ӧ������̬HI�ų�9kJ���� | |
| D�� | 0.5mol H2��0.5mol I2��ȫ��Ӧ��Ҫ����4.5kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
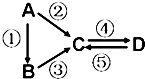 A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʣ�����֮�������µķ�Ӧ��ϵ��
A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʣ�����֮�������µķ�Ӧ��ϵ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com