
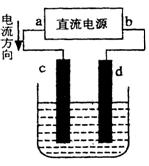
 (l)+O2(g) △H= -196.46kJ·mol-1
(l)+O2(g) △H= -196.46kJ·mol-1| A.铜可以溶解于稀盐酸与H2O2的混合溶液 |
| B.铜溶解于酸性双氧水的热化学方程式为: Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68 kJ·mol-  1 1 |
| C.反应①是在任何条件下都不可能发生的化学反应 |
| D.用H2O2和H2SO4的混合溶液溶解铜比用浓硫酸溶解铜环保 |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3的能量变化如下图所示,该反应的热化学方程式是
2NH3的能量变化如下图所示,该反应的热化学方程式是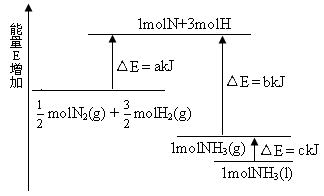
A.N2(g)+3H2(g) 2NH3(1) △H=2(a-b-c)kJ·mol-1 2NH3(1) △H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g) △H=2(b-a)kJ·mol-1 2NH3(g) △H=2(b-a)kJ·mol-1 |
C.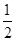 N2(g)+ N2(g)+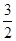 H2(g) H2(g) 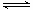 NH3(1) △H=(b+c-a)kJ·mol-1 NH3(1) △H=(b+c-a)kJ·mol-1 |
D.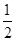 N2(g)+ N2(g)+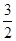 H2(g) H2(g)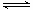 NH3(g) △H=(a+b)kJ·mol-1 NH3(g) △H=(a+b)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)
2SO3(g)  H = -190 kJ·mol-1
H = -190 kJ·mol-1 O2 (g) = CO2 (g)
O2 (g) = CO2 (g)  H = -283.0 kJ·mol-1
H = -283.0 kJ·mol-1 H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: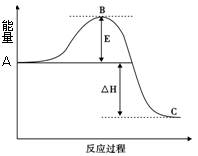
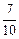 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)  2SO2(g) + O2(g)的平衡常数(写出计算过程)
2SO2(g) + O2(g)的平衡常数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g)进行过程中的能量变化曲线。曲线 a表示不使用催化剂时反应的能量变化,曲线 b表示使用催化剂后的能量变化。下列相关说法正确的是 ( )
CH3OH(g)进行过程中的能量变化曲线。曲线 a表示不使用催化剂时反应的能量变化,曲线 b表示使用催化剂后的能量变化。下列相关说法正确的是 ( )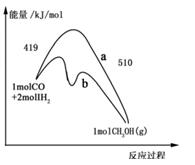
| A.其它条件不变,按曲线 b线进行的反应, CH3OH的产率更高 | |
| B.其它条件不变,分别按曲线 a.b线进行的反应的热效应相同 | |
C.(1molCO + 2molH2)中的键能之和比 1molCH3OH中的键能之和大  | D.热化学方程式为 CO(g)+2H2(g) CH3OH(g) △H=-91kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1 HgO(s);ΔH="-90.84" kJ·mol-1
HgO(s);ΔH="-90.84" kJ·mol-1 ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为| A.ΔH="+260.7" kJ·mol-1 | B.ΔH="-260.7" kJ·mol-1 |
| C.ΔH="-444.2" kJ·mol-1 | D.ΔH="+444.2" kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化学反应进行的过程中放出或吸收的热量称为反应热。 |
| B.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热。 |
| C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量。 |
| D.在101Kpa时,1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热反应生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 |
| B.放热反应反应物总能量大于产物总能量,△H<0 |
| C.放热反应不用加热就可以进行 |
| D.多数化合反应、所有的燃烧、酸碱中和反应、金属与酸反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com