
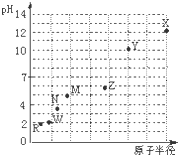
 第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A、气态氢化物的稳定性:M>N |
| B、Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C、X和W形成的常见化合物阴阳离子个数比为1:2 |
| D、Z和R组成的化合物是弱电解质 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤后的溶液中一定没有S2- |
| B、MnS难溶于水,可溶于MnCl2溶液中 |
| C、常温时,CuS、PbS、CdS比MnS更难溶 |
| D、加入MnS后生成CuS的离子方程式是Cu2++S2-=CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) | 通CO2 |
| 电离平衡移动的方向 | ||||||
| n(OH-) | ||||||
| c(OH-) | ||||||
| c(NH3?H2O) | ||||||
| 导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
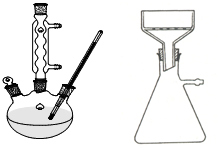 某实验室制取苯甲酸的过程如下:
某实验室制取苯甲酸的过程如下: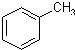 +2KMnO4
+2KMnO4| 反应Ⅰ |
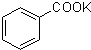 +MnO2+KOH+H2O
+MnO2+KOH+H2O| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g?(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com