
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
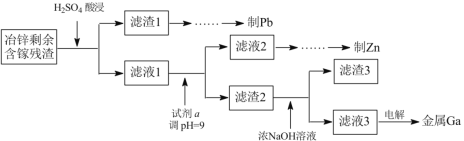
①试剂 a 是_______________。
②写出电解制镓时的阴极电极反应式__________________。
【答案】第三周期第ⅢA族 c Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价 GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O ZnO [Ga(OH)4]- +3e-=Ga+4OH-
【解析】
(1)Al是13号元素,位于元素周期表的第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)①a.镓与铝是同主族元素,同主族元素从上到下金属性增强,故Ga的金属性强于Al,所以碱性:Ga (OH)3> Al (OH)3,能用元素周期律解释,a不满足题意;
b.As与Ga同周期,Ga与Al是同主族元素,则Ga位于第ⅢA族,As 与 N 同主族,则As位于第ⅤA族,同周期元素从左往右,非金属性增强,故非金属性:As>Ga,能用元素周期律解释,b不满足题意;
c.H3AsO4和H3AsO3都是As的含氧酸,二者的酸性不能用元素周期律解释,c满足题意;
故答案为:c;
②Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价,故答案为:Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价;
③由题意可知GaAs作还原剂,浓HNO3作氧化剂,氧化产物为H3AsO4,浓硝酸对应的还原产物为NO2,结合电子得失守恒、原子守恒可写出该反应的化学方程式为:GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O,故答案为:GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O;
(3)①为提高浸取率,“H2SO4酸浸”时H2SO4应过量,滤液1显酸性,试剂a能消耗H+,使pH增大,同时不引入新的杂质,可用ZnO,故答案为:ZnO;
②Ga在碱性溶液中以[Ga(OH)4]- 形式存在,电解制镓,则阴极为[Ga(OH)4]-得电子生成Ga,阴极电极反应为:[Ga(OH)4]- +3e-=Ga+4OH-,故答案为:[Ga(OH)4]- +3e-=Ga+4OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() 。下列说法正确的是( )
。下列说法正确的是( )

A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.92.0g 甘油(丙三醇)中含有羟基数为1.0NA
C.22.4L(标准状况)氩气含有的质子数为18NA
D.1.0mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是金银花的主要抗菌、抗病毒有效药理成分之一,其结构如图所示。下列有关说法正确的是( )
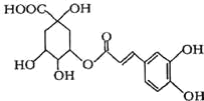
A.分子式为C16H16O9
B.能与碳酸钠溶液反应,但不产生二氧化碳
C.能发生催化氧化反应并生成能发生银镜反应的产物
D.NaOH、H2、溴水分别与1mol绿原酸反应时,消耗反应物的最大物质的量都为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机物的判断错误的是( )
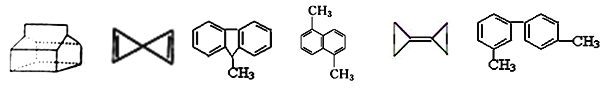
① ② ③ ④ ⑤ ⑥
A. 除①外,其它有机物均可使酸性高锰酸钾溶液褪色
B. ③④⑥都属于芳香烃。④⑥苯环上的一溴代物的同分异构体数目均有6种
C. ②⑤的一氯代物均只有一种,①的一氯代物有四种,④苯环上的二氯代物有9种,
D. ④⑤⑥的所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如图。
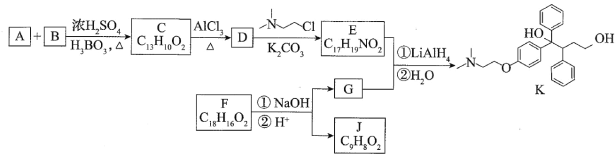
已知:
ⅰ.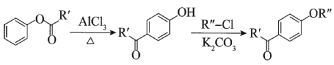 ;
;
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]() 。
。
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是_______。
(2)D中含有的官能团名称:_______。
(3)E的结构简式为_______。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为_______。
(5)M是J的同分异构体,符合下列条件的M的结构简式是_______。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1molM最多消耗2molNaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是_______。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
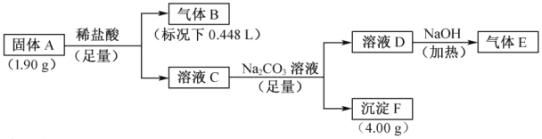
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件可生成乌洛托品(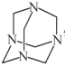 学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com