
【题目】如图是![]() 与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为
与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为![]() )为
)为![]() 。下列有关判断正确的是( )
。下列有关判断正确的是( )
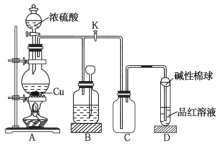
A.装置![]() 中盛装的是浓硫酸,作用是干燥
中盛装的是浓硫酸,作用是干燥![]()
B.装置![]() 为安全瓶,防止装置
为安全瓶,防止装置![]() 中的液体倒吸入装置
中的液体倒吸入装置![]() 中
中
C.品红溶液可检验生成的![]() ,碱性棉球的作用是吸收空气中的酸性气体
,碱性棉球的作用是吸收空气中的酸性气体
D.装置![]() 的作用是收集
的作用是收集![]()
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度t的关系:
CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C是常见的强酸,B是黄色非金属单质;E是紫红色金属单质,G是最常见的无色液体;D、F、I是常见的气体,D为红棕色,D与I组成元素相同,且相对分子质量相差16。
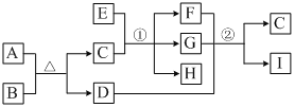
请回答下列问题:
(1)G的化学式为________。
(2)反应①的化学方程式为_____________________________。
(3)E与A的浓溶液反应的离子方程式为_________________________________。
(4)反应②的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中“实验内容”与对应“实验现象和结论”的关系都正确的是( )
选项 | 实验内容 | 实验现象和结论 |
A | 向FeCl3+3KSCN | 溶液的血红色变浅,说明增加生成物浓度,平衡逆移 |
B | 分别往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,记录褪色时间 | 乙先褪色,说明反应物浓度越大,反应速率越快,越先褪色 |
C | 室温下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,观察现象 | 溶液立即出现浑浊,说明不可逆反应是瞬间完成的 |
D | 向饱和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 无明显现象酸性:H3BO3<H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )

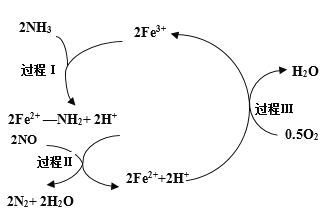
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸在如图所示装置中发生反应,实验中观察到的现象为![]() 试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;
试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;![]() 试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
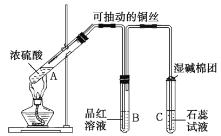
(1)![]() 试管中发生反应的化学方程式为______。
试管中发生反应的化学方程式为______。
(2)![]() 试管中先出现的气泡为______(填名称)。
试管中先出现的气泡为______(填名称)。
(3)实验完毕后取下![]() 试管,______,若溶液______,可证明使品红溶液褪色的物质为
试管,______,若溶液______,可证明使品红溶液褪色的物质为![]() 。
。
(4)![]() 试管中的现象是______。
试管中的现象是______。
(5)湿碱棉团的作用是______。
(6)实验完毕后,待溶液冷却后,取![]() 试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:____________。
试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:____________。
(7)将反应后的沉淀加入水中,黑色沉淀不溶解,灰白色沉淀大部分溶解,溶液变为蓝色,则灰白色沉淀的主要成分为____________。
(8)黑色沉淀可能为![]() 、
、![]() 或
或![]() ,根据所学知识,设计实验验证黑色沉淀中是否含有
,根据所学知识,设计实验验证黑色沉淀中是否含有![]() (已知
(已知![]() 、
、![]() 均为黑色固体,不溶于水和稀硫酸):____________。
均为黑色固体,不溶于水和稀硫酸):____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
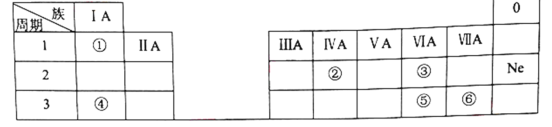
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com