
分析 ①少量氢氧化钡溶液中加入足量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水;
②氧化铝与过量氢氧化钠溶液混合反应生成偏铝酸钠和水;
③硫酸铝溶液和过量氨水混合生成硫酸铵和氢氧化铝.
解答 解:①少量氢氧化钡溶液中加入足量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水,离子方程式:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O;
故答案为:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O;
②氧化铝与过量氢氧化钠溶液混合反应生成偏铝酸钠和水,离子方程式:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
③硫酸铝溶液和过量氨水混合生成硫酸铵和氢氧化铝,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
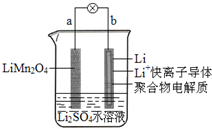 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池放电反应为LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价不发生变化 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA(注:粗铜含有Zn、Fe等杂质) | |
| B. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| C. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| D. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 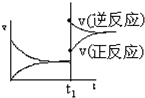 | C. |  | D. | 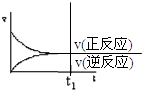 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaCl | KCl | MgO | AlCl3 | SiC | 晶体B | CCl4 | CBr | |
| 熔点/℃ | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com