
【题目】下列关于实验操作的说法正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 中和滴定实验中,锥形瓶用蒸馏水洗净须经烘箱烘干后才可使用
C. 配制0.5mol·L-1480mL的NaOH溶液需称量9.6 g NaOH固体
D. 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
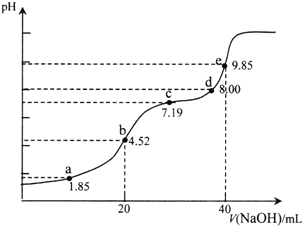
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的装置,如图所示,回答下列问题:

(1)乙醇、乙酸和浓硫酸混合顺序应为_____________________。
(2)收集乙酸乙酯的试管内盛有的饱和碳酸钠溶液的作用是____________________。
(3)反应中浓硫酸的作用________________________________。
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是_______________________。
(5)收集在试管内的乙酸乙酯是在碳酸钠溶液的________层。
(6)该反应的化学方程式为______________________。
(7)将收集到的乙酸乙酯分离出来的方法为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试完成下列问题:(提示:氢氧化钙的溶解度随温度升高而降低)

(1)实验中观察到的现象是______________________________________;
(2)产生上述现象的原因是______________________________________。
(3)写出有关反应的离子方程式____________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)如将本题中“25℃石灰水饱和溶液”换成“20℃碳酸饮料”进行探究实验,实验(1)中观察到的另一现象是________________,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Pt(NH3)4(NO2)Cl]CO3是一种铂的配合物,请回答下列相关问题。
(1) [Pt(NH3)4(NO2)Cl]CO3所含有的短周期元素中基态原子未成对电子数最多的是___________(填元素符号),与该元素同族的第四周期元素基态原子的最外层电子排布式是___________。
(2)CO32-的中心原子杂化形式是___________,空间构型是___________。
(3) [Pt(NH3)4(NO2)Cl]CO3中心原子的配位数是___________,与配体之一NO2-互为等电子体的单质分子化学式是___________。
(4)根据相互作用的分子种类不同可以把范德华力分为色散力、诱导力和取向力,其中取向力只存在于极性分子和极性分子之间,则在新制氯水中存在的取向力有___________种。
(5)如图是晶体铂的晶胞结构,则铂原子的配位数为___________,晶体铂的空间利用率为___________(用含“π”的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com