
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置来制取乙酸乙酯。试回答下列问题:

(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式__________。
(2)该反应需加入一定量的浓硫酸,则浓硫酸的主要作用是_______________。
(3)右边试管内所盛饱和碳酸钠溶液的主要作用是_______。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止___。
(5)若要把制得的乙酸乙酯分离出来,主要使用的玻璃仪器是_________。(答仪器的名称)
【答案】 CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O 催化作用,吸水作用 中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯 倒吸 分液漏斗
CH3CO18OCH2CH3+H2O 催化作用,吸水作用 中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯 倒吸 分液漏斗
【解析】(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O;(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂;(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;(4)乙醇和乙酸均与水互溶,导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;(5)乙酸乙酯不溶于水,若要把制得的乙酸乙酯分离出来需要分液,主要使用的玻璃仪器是分液漏斗。
CH3CO18OCH2CH3+H2O;(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂;(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;(4)乙醇和乙酸均与水互溶,导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;(5)乙酸乙酯不溶于水,若要把制得的乙酸乙酯分离出来需要分液,主要使用的玻璃仪器是分液漏斗。


科目:高中化学 来源: 题型:
【题目】已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
A.-332
B.-118
C.+350
D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(主要成分为乙酰水杨酸)是解热止痛、治疗感冒的药物。它是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应制得的。其反应原理如下:
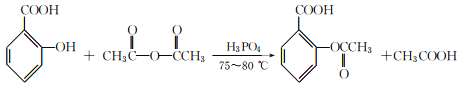
为避免醋酸酐水解,所用原料、仪器要充分干燥。有关物质的参数如下表:
名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
水 | 乙醇 | 乙酸乙酯 | |||||
水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
制取阿司匹林的工艺流程如下:
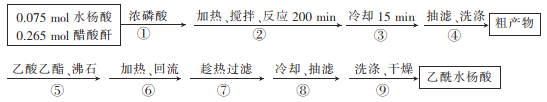
回答下列问题:
(1)浓磷酸的作用是__________。步骤②的加热方式为水浴加热,温度控制在________℃。
(2)向粗产物中加入乙酸乙酯的作用是_________________。
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是_________________
(4)精制后乙酰水杨酸的质量为8.91 g,则其产率为______,造成产率低的原因可能有__________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素由于其特殊的核外电子排布而其有特殊的性质,成为化学研究的重点和前沿。
(l)过波元素处于周期表的____区和f 区。
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+____(填“有”或“无”)颜色。
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式____,若其中两个CN-被NO2-替换,得到的配合物只有两种结构,则Ni(CN)42-的空间构型是_____, NO2-的空间构型是_____,其中N原子的杂化方式是_____。
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低___________。
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:

① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为_______。
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为_________。
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC—COOH)也称草酸,是一重要的化工原料和化工产品。利用石油化工产品中的烷烃可以生成草酸,生产流程如下:

已知上述框图中有机物B的相对分子质量比有机物A的相对分子质量大79。
请回答下列问题:
(1)A的结构简式是__________________。D的名称_________________。
(2)A生成B的反应类型是________________;C生成D的反应类型是_________________。
(3)写出有关的化学方程式:
B→C:______________________________________。
E→F:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Al(OH)3的性质叙述错误的是( )
A. Al(OH)3受热易分解生成Al2O3和H2O
B. Al(OH)3是难溶于水的白色胶状物质
C. Al(OH)3能凝聚水中的悬浮物,也能吸附色素
D. Al(OH)3既能溶于NaOH溶液、氨水,又能溶于盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置________;化合物M中含有的化学键类型有________________
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):______;写出C与A形成的18e-化合物的结构式_____________;
(3)用电子式表示A2C的形成过程:________________________________________
(4)写出题中生成M的化学方程式_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和一元醇A和饱和一元羧酸B的相对分子质量都为88,则A和B形成的酯共有(不考虑立体异构)( )
A. 16种B. 24种
C. 32种D. 40种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨主要用于制造硬质或耐高温的合金。自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。黑钨矿冶炼钨的工艺流程如下:
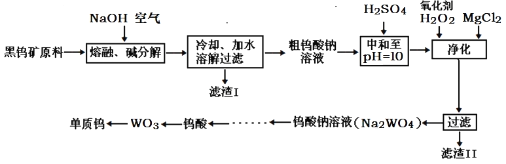
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为__________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是__________,滤渣Ⅱ的主要成分是__________。
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表。
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成分 | WO3 W2O5 WO2 W |
已知:温度过高时,WO2(s)可转变为WO2(g)。
WO2(s)+2H2(g) ![]() W(s)+2H2O(g) △H =+66.0 kJ·mol-1
W(s)+2H2O(g) △H =+66.0 kJ·mol-1
WO2(s) ![]() WO2(g) △H =+203.9 kJ·mol-1
WO2(g) △H =+203.9 kJ·mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为_____________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小。不同温度下两种物质的沉淀溶解平衡曲线如右图,则T1时Ksp(CaWO4) =________。
在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为________。
(5)利用电解法可以从碳化钨(WC)废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com