
25℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量浓度之比是
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:选择题
下列各项中,不能运用化学平衡移动原理解释的是( )
A.实验室中用饱和食盐水除去氯气中的氯化氢气体
B.实验室中久置的浓氨水碱性减弱
C.向硝酸亚铁溶液中滴加盐酸,溶液变为黄色
D.在较高温度下测定二氧化氮气体相对分子质量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量
A.①② B.②③ C.①③  D.①④
D.①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中:NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
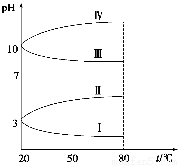
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
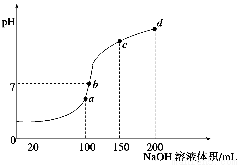
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:选择题
室温时,将xmL pH=a的稀NaOH溶液与ymL PH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14.则pH﹥7 B..若10x=y,且a+b=13.则pH=7
C.若ax=by,且a+b=13.则pH<7 D.若x=10y,且a+b=14.则pH=7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:选择题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
实验编号 | c(HA)/mol·L-1) | c(NaOH)/mol·L-1 | 混合后溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | b | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH<7 |
丁 | 0.1 | 0.1 | pH=c |
下列对混合后溶液的有关说法重,不正确的是
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)= C(Na+)
C.丙中:若HA是弱酸,则c(CH3COO-)/c(CH3COOH)<1
D.丁中:若 c=9,则c(OH-)-c(HA)=10-9mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:填空题
t℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积固定不变),发生如下反应:3A(g)+B(g) xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:选择题
100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量6 mol.L-1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子 的中子数与电子数之差为:
的中子数与电子数之差为:
A. 0 B. 57 C. 118 D. 175
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com