
����Ŀ����1��800��ʱ��ij�ܱ������д������·�Ӧ��2NO2(g) ![]() 2NO(g) + O2(g) ��H��0������ʼ�������м���1mol/L��NO2����Ӧ������NO��Ũ����ʱ��ı仯��ͼ����I��ʾ
2NO(g) + O2(g) ��H��0������ʼ�������м���1mol/L��NO2����Ӧ������NO��Ũ����ʱ��ı仯��ͼ����I��ʾ
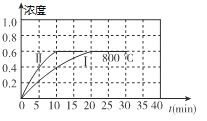
�ٷ�Ӧ������ڷ�ӦI���ԣ��ı������������_______________��
��800��ʱ������ʼʱ��������ͬʱ����1mol/LNO��0.2mol/LO2��0.5mol/L NO2����v��____________v��������<������>������=����
��2����֪N2O4(g) ![]() 2NO2(g) ��H=+57.20kJ/mol��t minʱ����һ������NO2��N2O4������һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
2NO2(g) ��H=+57.20kJ/mol��t minʱ����һ������NO2��N2O4������һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c��X��/��mol/L�� | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c��Y����mol/L�� | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
��c(X)����__________���ѧʽ����Ũ�ȣ��÷�Ӧ��ƽ�ⳣ��K=_____________��
��ǰ10min����NO2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ___________��20minʱ�ı��������_____________�����´ﵽƽ��ʱ��NO2����������___________________��
a������ b����С
c������ d�����ж�
���𰸡�������� < NO2 0.9mol/L 0.04mol/(L��min) ����0.8molNO2 b
��������
���⿼����������ԭ������ѧƽ�ⳣ���ļ��㡢��ѧ��Ӧ���ʵļ��㣬��1��������ͼ�ﵽƽ���NO��Ũ����ȣ���II�ķ�Ӧ���ʱ�I�죬˵��ʹ���˴�������800��ʱ����ѧƽ�ⳣ��K= 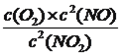 ���ﵽƽ���c(NO)=0.6mol��L��1��c(O2)=0.3mol��L��1��c(NO2)=0.4mol��L��1��������������ʽ��K=0.675������ʼʱ��������ͬʱ����1mol��L��1NO��0.2mol��L��1O2��0.5mol��L��1 NO2����ʱQc=
���ﵽƽ���c(NO)=0.6mol��L��1��c(O2)=0.3mol��L��1��c(NO2)=0.4mol��L��1��������������ʽ��K=0.675������ʼʱ��������ͬʱ����1mol��L��1NO��0.2mol��L��1O2��0.5mol��L��1 NO2����ʱQc=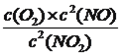 =0.8>0.625��˵���˷�Ӧ���淴Ӧ������У�v��<v�棻��2���ٸ��ݱ������ݣ�10minʱ�ﵽƽ�⣬X���ɵ�Ũ��Ϊ0.4mol��L��1��Y����Ũ��Ϊ0.2mol��L��1�����ݷ�Ӧ����ʽ��XΪNO2��YΪN2O4����ѧƽ�ⳣ��K=
=0.8>0.625��˵���˷�Ӧ���淴Ӧ������У�v��<v�棻��2���ٸ��ݱ������ݣ�10minʱ�ﵽƽ�⣬X���ɵ�Ũ��Ϊ0.4mol��L��1��Y����Ũ��Ϊ0.2mol��L��1�����ݷ�Ӧ����ʽ��XΪNO2��YΪN2O4����ѧƽ�ⳣ��K=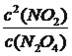 =0.62/0.4=0.9�������ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(NO2)=(0.6��0.2)/10mol/(L��min)=0.04 mol/(L��min)��20minʱ��N2O4��Ũ��û�з����仯��NO2��Ũ�����ӣ���˸ı������ʱ����0.8molNO2���ٳ���0.8molNO2���൱����ԭ���Ļ���������ѹǿ��ƽ�����淴Ӧ�����ƶ�������NO2����NO2������������С����b��ȷ��
=0.62/0.4=0.9�������ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(NO2)=(0.6��0.2)/10mol/(L��min)=0.04 mol/(L��min)��20minʱ��N2O4��Ũ��û�з����仯��NO2��Ũ�����ӣ���˸ı������ʱ����0.8molNO2���ٳ���0.8molNO2���൱����ԭ���Ļ���������ѹǿ��ƽ�����淴Ӧ�����ƶ�������NO2����NO2������������С����b��ȷ��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp��AgCl��=1.56��10-10��Ksp��AgBr��=7.7��10-13��Ksp��Ag2CrO4��=9.0��10-12��ij��Һ�к���Cl-��Br-��CrO42-Ũ�Ⱦ�Ϊ0.010mol.L-1�������Һ����μ���0.010mol.L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ��������
A. Cl-��Br-��CrO42- B. CrO42-��Br-��Cl-
C. Br-��Cl-��CrO42- D. Br-��CrO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ��������Ļ�ѧ��ҵ֮һ������Ĥ��ⷨΪĿǰ�ձ�ʹ�õ�����������������������ͼ1��ʾ��
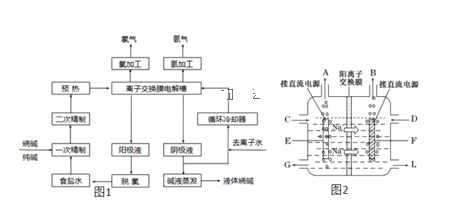
��1���������п���ѭ����������____��
��2����ⷨ�Ƽ����Ҫԭ���DZ���ʳ��ˮ�����ڴ���ˮ�к���Ca2+��Mg2+��SO42���������ʣ������ڽ������ǰ��Ҫ�������ξ��ƣ�д��һ�ξ����з��������ӷ���ʽ___��
��3��ͼ2�ǹ�ҵ�ϵ�ⱥ��ʳ��ˮ�����ӽ���Ĥ����ʾ��ͼ�������ý��������Ƴɣ�������̼�����Ƴɣ�����B��������������___��E�缫��������___������ܷ�Ӧ�����ӷ���ʽΪ____��
��4���������۳����ĵ���ˮ�У����������������ܽ��ȣ���Ҫ����8%��9%������������Һ���䳹�׳�ȥ���÷�Ӧ�Ļ�ѧ����ʽΪ___��
��5����֪�ڵ����У�ÿСʱͨ��1�����ֱ������Բ���1.492g���ռij������300�����۴�������8Сʱ���Ƶ�32%���ռ���Һ���ܶ�Ϊ1.342��/m3��113m3�����۵ĵ���ǿ��1.45��104A���õ��۵ĵ��Ч��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ܱ������������淴ӦA(s) ![]() B+C(g) ��H=��Q kJ��mol��1 �ﵽƽ�⡣��С������������´ﵽƽ��ʱ��C(g)��Ũ������С���ǰ��ƽ��Ũ����ȡ����·�����ȷ����
B+C(g) ��H=��Q kJ��mol��1 �ﵽƽ�⡣��С������������´ﵽƽ��ʱ��C(g)��Ũ������С���ǰ��ƽ��Ũ����ȡ����·�����ȷ����
A. ����B��״ֻ̬��Ϊ��̬��Һ̬
B. ƽ��ʱ����λʱ����n(A)�����sn(C)����=1�s1
C. ����������䣬��ƽ����ϵ�м���B��ƽ��һ�����淴Ӧ�����ƶ�
D. ����ʼʱ�������м���1 mol B��1 mol C���ﵽƽ��ʱ��������QkJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼװ����һ�������S��C��Si����Ԫ�صķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼװ������֤±��Ԫ�ص����ʵݱ���ɣ�A��B��C�����ֱ���պ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ����������

��1����ͼ������A��������____����ͬѧʵ�鲽�裺����������______����ҩƷ�������Լ���
��2������ͼ������A��ʢ���Լ�ϡ���ᣬ��ƿB�е�ʢ���Լ�Ϊ___��Һ��C�е�ʢ���Լ�Ϊ______��Һ��
����˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ��������_________��
��3����ͼ��A����Ӧ�����ӷ���ʽΪ__________��
��4����ͬѧ������ͼ��B����ֽ������C����ֽ��ɫ���ݴ�____�����������������������ó���ķǽ�����ǿ�ڵ⣬������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��ȫ�ӳɺ�����������2��2��3��������������ǣ� ��
A. 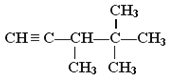 B.
B. 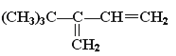
C. CH2��CHC(CH3)2CH(CH3)2D. (CH3)3CC(CH3)��CHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ�û����������ȷ���ǣ� ��
A.  ����ʵ��������ϩ
����ʵ��������ϩ
B. 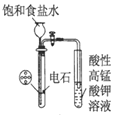 ����ʵ��������Ȳ��������Ȳ
����ʵ��������Ȳ��������Ȳ
C.  ����ʵ�����з���ʯ��
����ʵ�����з���ʯ��
D.  ��AΪ���ᣬBΪ̼��ƣ�CΪ��������Һ�������֤���ԣ�����>̼��>����
��AΪ���ᣬBΪ̼��ƣ�CΪ��������Һ�������֤���ԣ�����>̼��>����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 mL 0.1 mol��L��1 NH4Al(SO4)2��Һ�У��μӵ�Ũ��Ba(OH)2��Һx mL������������ȷ����
A.x��10ʱ����Һ����NH4+��Al3����SO42-����c(NH4+)��c(Al3��)
B.x��20ʱ����Һ����������Ӧ�����ӷ���ʽΪAl3����2SO42-��2Ba2����4OH��=AlO2-��2H2O��2BaSO4��
C.x��30ʱ����Һ����Ba2����AlO2-��OH������c(OH��)<c(AlO2-)
D.�μӹ����У����ɳ�����������ʵ���Ϊ0.003 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ϸ����Ԫ�ء������P�����ã�a��b��c��d����С�������ʣ�A��B��C������������ʣ�����������ȷ���� (����)��
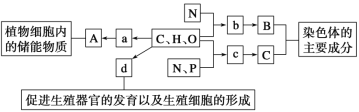
������A�ǵ��ۺ���ά�أ��ڶ���ϸ��������������ƹ��ܵ���������ԭ��
������a��b��c�ֱ�Ϊ�����ǡ������ᡢ�������ǡ�
������d����ϸ��ʱ����Ҫ����ATP��Ҳ����Ҫ�����Э����
���������������������B��С��������b�������������ͬ�������������������Bһ����ͬ
A. 0��B. 1��C. 2��D. 3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com