
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是

A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有![]() ,请按要求填空:
,请按要求填空:
(1)在水溶液中,水解后溶液呈碱性的离子是___________________________________________________________________________。
(2)在水溶液中,水解后溶液呈酸性的离子是_____________________________________________________________________________。
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的离子有__________________________________________________________。
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的离子有_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
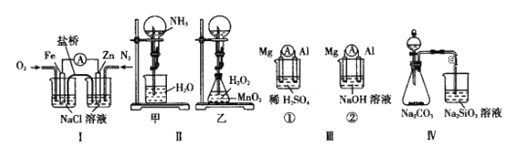
A.图I装置中通入N2和O2的作用是相同的
B.图II中甲、乙两装置产生喷泉的原理一样
C.图III①装置中镁片是原电池的负极,②装置镁片是原电池的正极
D.图IV分液漏斗中盛硝酸能证明非金属性:N>C>Si,盛硫酸能证明非金属性:S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是
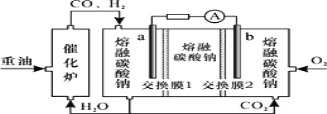
A.O2在b极得电子,最终被还原为CO32
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32经“交换膜2”移向b极
D.H2参与的电极反应为:H22e+CO32=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应B.铜和稀硫酸反应
C.氧化铜和硫酸反应D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
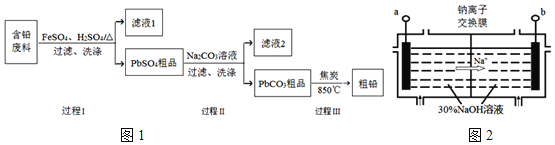
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是
①糖类、蛋白质、油脂属于天然高分子化合物
②煤经气化和液化两个物理变化过程,可变为清洁能源
③制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
④用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
⑤苯、油脂均不能使酸性![]() 溶液褪色
溶液褪色
⑥葡萄糖、果糖的分子式均为![]() ,二者互为同分异构体
,二者互为同分异构体
⑦甲烷和![]() 的反应与乙烯和
的反应与乙烯和![]() 的反应属于同一类型的反应
的反应属于同一类型的反应
⑧乙醇、乙酸均能与Na反应放出![]() ,二者分子中官能团相同
,二者分子中官能团相同
⑨中和滴定实验时,用待测液润洗锥形瓶
⑩非金属元素组成的化合物中只含共价键
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。下图是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:

回答下列问题:
(1)为提高反应①的浸出速率,可采用的措施为____(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式____。
(3)反应②为Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq);常温下的Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq)的化学平衡常数的数量级为____。

(4)写出反应④的化学方程式____。
(5)室温下,H2SeO3水溶液中H2SeO3、HSeO3-、SeO32-的摩尔分数随pH的变化如图所示,则室温下H2SeO3的Ka2=___。
(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生____(写电极反应式),若用10A的电流电解60min后,得到32.4gAg,则该电解池的电解效率为____%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
CH3CH2CH2COOH ________________
CH3CH2CH2CH2-Cl ________________
HCOOC2H5 _____________
CH3CHO ___________
CH3CH2CH=CHCH3______________
![]() _________
_________
![]() ___________
___________
![]() __________
__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com