
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为( )
A. 1:2:3 B. 1:6:9 C. 1:3:3 D. 1:3:6
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在指定溶液中大量共存的是( )
A.无色溶液中:Na+、MnO4﹣、CO32﹣、Cl﹣
B.能使紫色石蕊试剂变红的溶液中:OH﹣、K+、Ba2+、Na+
C.透明的酸性溶液中:Fe3+、Mg2+、Cl﹣、NO3﹣
D.pH=1的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2样品,请设计实验测定该样品的纯度。可供选择的装置如图:
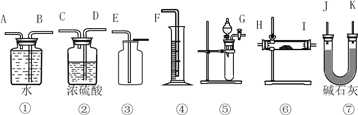
(1)选用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,选择的仪器组合是____________。
A.①②④⑤ B.①④⑤
C.⑤⑥⑦ D.①③⑤⑦
(2)实验中选用装置的连接顺序是_________________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式,并用双线桥标注电子转移的方向和数目__________。若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为168mL(标准状况),则Na2O2试样的纯度为_________。
(4)向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是________。
A.最后溶液变蓝 B.溶液先变蓝后褪色
C.溶液仍为紫色 D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.发生反应2A(g)+B(g)2C(g),达到平衡后,恢复至温度.下列有关说法不正确的是
( )
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10﹣5、K1=4.3×10﹣7 , 下列说法正确的是(不考虑饮料中其他成分)( )
A.提高CO2充气压力,饮料中c(A﹣)不变
B.当pH为5.0时,饮料中 ![]() =0.16
=0.16
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A﹣>HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4L HCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρ g/cm3 , 溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100% c=1molL﹣1 向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w 所得溶液中含有NA个HCl分子.
×100% c=1molL﹣1 向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w 所得溶液中含有NA个HCl分子.
A.全部
B.①③④
C.①③
D.只有①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com