
 2NO2(g)өДЖҪәвЎЈПВНјұнКҫІв¶ЁN2O4өДЕЁ¶ИУлКұјд№ШПөөДЗъПЯЈЁЧЭЧшұкОӘN2O4өДЕЁ¶ИЈ¬әбЧшұкОӘКұјдЈ©ЎЈ
2NO2(g)өДЖҪәвЎЈПВНјұнКҫІв¶ЁN2O4өДЕЁ¶ИУлКұјд№ШПөөДЗъПЯЈЁЧЭЧшұкОӘN2O4өДЕЁ¶ИЈ¬әбЧшұкОӘКұјдЈ©ЎЈ
|
| T/K | 310 | 320 |
| KЦө | 0.38 | 0.42 |

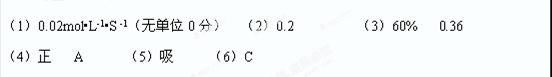
 2NO2(g)ҙпЖҪәвәуФЩідИл0.10 mol N2O4ЖшМеЈ¬ФцҙуБЛ·ҙУҰОпЕЁ¶ИЖҪәвПтХэПтТЖ¶ҜЈ»ФЩјУИлN2O4әуЈ¬ЖҪәвЧҙМ¬ПаөұУЪФцҙуС№ЗҝЈ¬ЖҪәвЧуТЖЈ¬N2O4өДЧӘ»ҜВКјхРЎЈ»
2NO2(g)ҙпЖҪәвәуФЩідИл0.10 mol N2O4ЖшМеЈ¬ФцҙуБЛ·ҙУҰОпЕЁ¶ИЖҪәвПтХэПтТЖ¶ҜЈ»ФЩјУИлN2O4әуЈ¬ЖҪәвЧҙМ¬ПаөұУЪФцҙуС№ЗҝЈ¬ЖҪәвЧуТЖЈ¬N2O4өДЧӘ»ҜВКјхРЎЈ» 2NO2(g) Хэ·ҙУҰОӘОьИИ·ҙУҰЈ¬ЙэОВЖҪәвПтХэПтТЖ¶ҜЈ¬N2O4өДЖҪәвЕЁ¶ИјхРЎЈ¬ЙэОВ·ҙУҰЛЩВКјУҝмЈ¬ҝЙЛх¶МҙпЖҪәвөДКұјдЈ¬ҪбәПНјПсСЎCЎЈ
2NO2(g) Хэ·ҙУҰОӘОьИИ·ҙУҰЈ¬ЙэОВЖҪәвПтХэПтТЖ¶ҜЈ¬N2O4өДЖҪәвЕЁ¶ИјхРЎЈ¬ЙэОВ·ҙУҰЛЩВКјУҝмЈ¬ҝЙЛх¶МҙпЖҪәвөДКұјдЈ¬ҪбәПНјПсСЎCЎЈ

 ЖЪД©іеҙМ100·ЦҙҙРВҪрҫнНкИ«КФҫнПөБРҙр°ё
ЖЪД©іеҙМ100·ЦҙҙРВҪрҫнНкИ«КФҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 CO2 (g) + H2(g) ЎчHЈҪQ kJ/mol ЎЈТСЦӘёГ·ҙУҰөДЖҪәвіЈКэKУлОВ¶ИTөД№ШПөИзНјЛщКҫЎЈИфФЪТ»№М¶ЁөДГЬұХИЭЖчЦРЈ¬ 850Ўж Кұ·ўЙъЙПКц·ҙУҰЈ¬ІвөГИЭЖчДЪёчОпЦКөДЕЁ¶И (mol/L)ЛжКұјдөДұд»Ҝ№ШПөИзПВұнЈә
CO2 (g) + H2(g) ЎчHЈҪQ kJ/mol ЎЈТСЦӘёГ·ҙУҰөДЖҪәвіЈКэKУлОВ¶ИTөД№ШПөИзНјЛщКҫЎЈИфФЪТ»№М¶ЁөДГЬұХИЭЖчЦРЈ¬ 850Ўж Кұ·ўЙъЙПКц·ҙУҰЈ¬ІвөГИЭЖчДЪёчОпЦКөДЕЁ¶И (mol/L)ЛжКұјдөДұд»Ҝ№ШПөИзПВұнЈә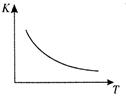

| AЈ®өҘО»КұјдДЪјхЙЩ CO(g)өДЕЁ¶ИөИУЪЙъіЙ CO2 (g)өДЕЁ¶И |
| BЈ®·ҙУҰИЭЖчДЪөДС№ЗҝІ»·ўЙъұд»Ҝ |
| CЈ®»мәПЖшМеЦР H2 (g)өДЕЁ¶ИІ»ФЩ·ўЙъёДұд |
| DЈ®ЗвЖшөДЙъіЙЛЩВКөИУЪЛ®өДЙъіЙЛЩВК |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2C(g) ҰӨH < 0ЎЈt1КұҝМҙпөҪЖҪәвәуЈ¬ФЪt2КұҝМёДұдДіТ»МхјюЈ¬Жд·ҙУҰ№эіМИзНјЎЈПВБРЛө·ЁХэИ·өДКЗ
2C(g) ҰӨH < 0ЎЈt1КұҝМҙпөҪЖҪәвәуЈ¬ФЪt2КұҝМёДұдДіТ»МхјюЈ¬Жд·ҙУҰ№эіМИзНјЎЈПВБРЛө·ЁХэИ·өДКЗ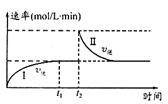
| AЈ®0Ў«t2КұЈ¬vХэ>vДж |
| BЈ®ўсЎўўтБҪ№эіМҙпөҪЖҪәвКұЈ¬AөДМе»э·ЦКэўс>ўт |
| CЈ®t2КұҝМёДұдөДМхјюҝЙТФКЗПтГЬұХИЭЖчЦРјУC |
| DЈ®ўсЎўўтБҪ№эіМҙпөҪЖҪәвКұЈ¬ЖҪәвіЈКэI<ўт |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 pC(g) ЎчH=Q kJЎӨmol-1Ј¬ФЪГЬұХИЭЖчЦРҪшРРЈ¬ПВНјұнКҫФЪІ»Н¬КұјдtЎўОВ¶ИTЎўС№ЗҝPУл·ҙУҰОпBөД°Щ·Цә¬БҝөД№ШПөЗъПЯЈ¬ПВБРЕР¶ПХэИ·өДКЗ
pC(g) ЎчH=Q kJЎӨmol-1Ј¬ФЪГЬұХИЭЖчЦРҪшРРЈ¬ПВНјұнКҫФЪІ»Н¬КұјдtЎўОВ¶ИTЎўС№ЗҝPУл·ҙУҰОпBөД°Щ·Цә¬БҝөД№ШПөЗъПЯЈ¬ПВБРЕР¶ПХэИ·өДКЗ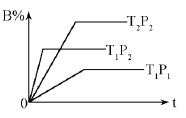
| AЈ®T2ЈҫT1P1Јҫ P2 m+n Јҫ p ҰӨ Ұ§Јј0 |
| BЈ®T1ЈҫT2P1Јј P2 m+n Јј p ҰӨ Ұ§Јҫ0 |
| CЈ®T1ЈјT2P1Јј P2 m+n Јј p ҰӨ Ұ§Јј0 |
| DЈ®T1 ЈҫT2P1Јј P2 m+n Јҫ p ҰӨ Ұ§Јҫ0 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 xC(g)Ј«2D(g)Ј¬ 2 minәуёГ·ҙУҰҙпөҪЖҪәвЈ¬ЙъіЙ0.8 mol DЈ¬ІўІвөГCөДЕЁ¶ИОӘ0.2 molЎӨLЈӯ1ЎЈФтПВБРЕР¶ПХэИ·өДКЗ
xC(g)Ј«2D(g)Ј¬ 2 minәуёГ·ҙУҰҙпөҪЖҪәвЈ¬ЙъіЙ0.8 mol DЈ¬ІўІвөГCөДЕЁ¶ИОӘ0.2 molЎӨLЈӯ1ЎЈФтПВБРЕР¶ПХэИ·өДКЗ | AЈ®xЈҪ2 |
| BЈ®2 minДЪAөД·ҙУҰЛЩВКОӘ0.6 molЎӨLЈӯ1ЎӨminЈӯ1 |
| CЈ®BөДЧӘ»ҜВКОӘ40% |
| DЈ®Иф»мәПЖшМеөДГЬ¶ИІ»ұдЈ¬ФтұнГчёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 CO2(g)+H2(g)ДіСРҫҝРЎЧй·ЦұрФЪМе»эҫщОӘ2LөДәгИЭГЬұХИЭЖчЦРјУИлТ»¶ЁБҝөД·ҙУҰОпЈ¬К№Жд·ўЙъ·ҙУҰЈ¬Па№ШКэҫЭИзПВЈә
CO2(g)+H2(g)ДіСРҫҝРЎЧй·ЦұрФЪМе»эҫщОӘ2LөДәгИЭГЬұХИЭЖчЦРјУИлТ»¶ЁБҝөД·ҙУҰОпЈ¬К№Жд·ўЙъ·ҙУҰЈ¬Па№ШКэҫЭИзПВЈә| ИЭЖчұаәЕ | ОВ¶ИЎж | ЖрКјБҝ/mol | ЖҪәвБҝ/mol | ҙпөҪЖҪәвөДКұјд/min | ҙпөҪЖҪәвКұМеПөДЬБҝөДұд»Ҝ/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ўЩ | 650 | 1 | 2 | 0Ј®4 | 0Ј®4 | 5 | 16Ј®4 |
| ўЪ | 650 | 2 | 4 | | | t1 | Q1 |
| ўЫ | 900 | 2 | 4 | 1Ј®6 | 1Ј®6 | t2 | Q2 |
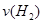 =__________ЎЈ
=__________ЎЈ CO2(g)+H2(g) ЎчH= -41kJ/mol
CO2(g)+H2(g) ЎчH= -41kJ/molІйҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 xC(g)ЎЈИфИЭЖчМе»э№М¶ЁОӘ2LЈ¬·ҙУҰ1minКұІвөГКЈУа1.8molAЈ¬CөДЕЁ¶ИОӘ0.4mol/LЎЈЗлМоРҙПВБРҝХ°ЧЈә
xC(g)ЎЈИфИЭЖчМе»э№М¶ЁОӘ2LЈ¬·ҙУҰ1minКұІвөГКЈУа1.8molAЈ¬CөДЕЁ¶ИОӘ0.4mol/LЎЈЗлМоРҙПВБРҝХ°ЧЈәІйҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 2NO2(g)МеПөЦРЈ¬n(NO)ЛжКұјдөДұд»ҜИзұнЈә
2NO2(g)МеПөЦРЈ¬n(NO)ЛжКұјдөДұд»ҜИзұнЈә| Кұјд(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
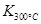 Јҫ
Јҫ Ј¬ФтёГ·ҙУҰКЗ ИИ·ҙУҰЎЈ
Ј¬ФтёГ·ҙУҰКЗ ИИ·ҙУҰЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2SO3(g) +Q
2SO3(g) +Q
| AЈ®НјТ»СРҫҝөДКЗОВ¶ИЎўС№Зҝ¶ФЖҪәвөДУ°ПмЈ¬әбЧшұкұнКҫС№Зҝ |
| BЈ®Нј¶юСРҫҝөДКЗОВ¶И¶ФЖҪәвөДУ°ПмЈ¬ўтІЙУГөДОВ¶ИёьёЯ |
| CЈ®НјИэЦРt0КұК№УГБЛҙЯ»ҜјБЈ¬К№ЖҪәвПтХэ·ҙУҰ·ҪПтҪшРР |
| DЈ®НјЛДЦРt0КұФцҙуС№ЗҝЈ¬К№ЖҪәвПтХэ·ҙУҰ·ҪПтҪшРР |
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com