


 N2+3H2
N2+3H2 N2+3H2
N2+3H2 N2O4
N2O4 N2O4
N2O4 ;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl
;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl ;Mg3N2+6HCl=3MgCl2+2NH4Cl;
;Mg3N2+6HCl=3MgCl2+2NH4Cl; N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3
N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3 N2+3H2,假设氨气消耗量为x
N2+3H2,假设氨气消耗量为x N2+3H2
N2+3H2| 2-1 |
| 2-1+0.5+1.5 |
 N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深;
N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深; N2O4; 先变深后变浅,但比最开始的颜色要深;
N2O4; 先变深后变浅,但比最开始的颜色要深;

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:

| ||
| ||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;

查看答案和解析>>
科目:高中化学 来源:2010年北京市西城区高二下学期期末考试化学试题 题型:填空题
(14分) 下图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精。已知D在标准状况下的密度为1.25 g/L,其产量可以用来衡量一个国家石油化工发展水平。E是生活中常见的一种有机物。各物质间转化关系如下: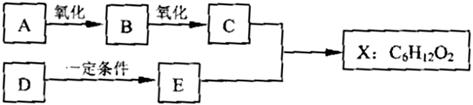
请回答下列问题。
(1)A的名称是 。
(2)B中所含的官能团是 。
(3)C+E X的化学反应类型是 反应。
X的化学反应类型是 反应。
(4)写出任意两种与A具有相同官能团的A的同分异构体的结构简式(不含A):
、 。
(5)X与氢氧化钠溶液反应的化学方程式是
。
(6)以D为原料生产一种常见塑料的化学方程式是
。
查看答案和解析>>
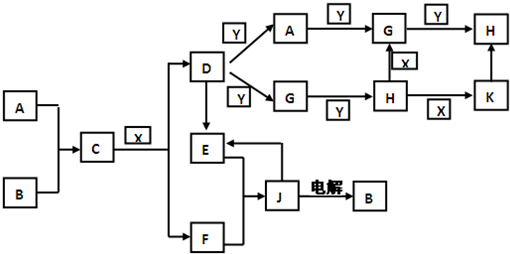
科目:高中化学 来源:山东省模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com