
| 4 |
| 8 |
| 0.4mol/L×0.4mol/L |
| (0.8mol/L)2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||||
| (2-x)2 |
| 1mol/L |
| 2mol/L |
| 1 |
| 2 |
| (1mol/L+0.5mol/L+0.5mol/L)×5L |
| (0.8mol/L+0.4mol/L+0.4mol/L)×5L |
| 2.8L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
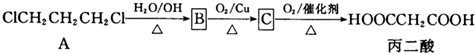
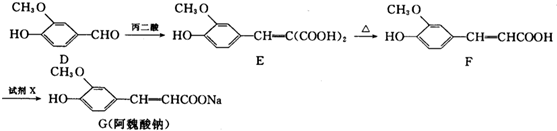
| 丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
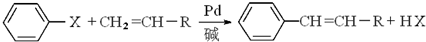 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)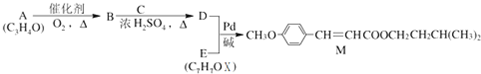
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
| C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、b点时c(Ba2+)?c(SO42- )小于Ksp |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、加水稀释可以使溶液由b点变到c点 |
| D、加入适量的Na2SO4不可能使溶液由a点变到c点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com