
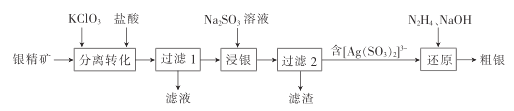
����Ŀ����������(��Ҫ�ɷ�ΪAg2S)Ϊԭ�ϲ�����Ԥ����ʪ��������������������:
(1)N2H4�ĵ���ʽΪ________________________��
(2)������ת����ʱ,Ag2Sת��ΪAgCl��S�Ļ�ѧ����ʽΪ______________(ClO3-��ԭΪCl- );Ϊ���Ag2S��ת���ʿɲ�ȡ�Ĵ�ʩ��_____________(�о�2��)����֪:Ksp(Ag2S)=1. 6��10-49 ,Ksp(AgCl)=2. 0��10-10 ,������KClO3,ֱ�Ӽ��Ȼ���,���ݷ�ӦAg2S+2Cl-![]() 2AgCl+S2- ,�ܷ�ʵ�������ȫת��?��˵������:________________
2AgCl+S2- ,�ܷ�ʵ�������ȫת��?��˵������:________________
(3)��������ʱ��������Ӧ�����ӷ���ʽΪ________________________��
(4)����ԭ��ʱ,2[ Ag(SO3)2]3- +N2H4+2OH -=2Ag��+4SO32- +N2��+H2��+ 2H2O,�÷�Ӧÿ����1 mol Agת�Ƶ��ӵ����ʵ���Ϊ___________��
���𰸡�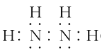 3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O �ʵ��ӳ���ȡʱ�䣬��С��������ֱ�����ʵ����߽���ʱ���¶ȵ� ���ܣ��÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת�� AgCl+2SO32-=[Ag(SO3)2]3 +Cl 2mo1
3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O �ʵ��ӳ���ȡʱ�䣬��С��������ֱ�����ʵ����߽���ʱ���¶ȵ� ���ܣ��÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת�� AgCl+2SO32-=[Ag(SO3)2]3 +Cl 2mo1
��������
������ת����ʱ��Ag2S��HCl��KClO3��Ӧת��ΪAgCl��S��KCl��H2O�����ˣ���������ʱ��AgCl��SO32 ��Ӧ����[Ag(SO3)2]3������ԭ��ʱ��[Ag(SO3)2]3 ��N2H4��NaOH��Ӧ����Ag��SO32��N2��H2��H2O��
(1)N2H4�е����������ۼ���ÿ�����ֱ����������γɹ��ۼ������͵�֮��һ�Թ��õ��ӣ���˵���ʽΪ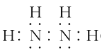 ���ʴ�Ϊ��
���ʴ�Ϊ��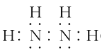 ��
��
(2)������ת����ʱ��Ag2S��HCl��KClO3��Ӧת��ΪAgCl��S��KCl��H2O���仯ѧ����ʽΪ3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O��Ϊ���Ag2S��ת���ʿɲ�ȡ�Ĵ�ʩ���ʵ��ӳ���ȡʱ�䣬��С��������ֱ�����ʵ����߽���ʱ���¶ȵ�(�о�2��)�����ݷ�ӦAg2S+2Cl��![]() 2AgCl+S2��
2AgCl+S2�� ���÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת�����ʴ�Ϊ��3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O���ʵ��ӳ���ȡʱ�䣬��С��������ֱ�����ʵ����߽���ʱ���¶ȵ�(�о�2��)�����ܣ��÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת����
���÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת�����ʴ�Ϊ��3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O���ʵ��ӳ���ȡʱ�䣬��С��������ֱ�����ʵ����߽���ʱ���¶ȵ�(�о�2��)�����ܣ��÷�Ӧ��ƽ�ⳣ����С(K=41030)����������ת����
(3)��������ʱ��AgCl��SO32 ��Ӧ����[Ag(SO3)2]3���䷢����Ӧ�����ӷ���ʽΪAgCl+ 2SO32 = [Ag(SO3)2]3 +Cl�����ʴ�Ϊ��AgCl+2SO32 = [Ag(SO3)2]3 +Cl����
(4)����ԭ��ʱ��2[Ag(SO3)2]3 +N2H4+2OH�� =2Ag��+4SO32 + N2��+H2��+ 2H2O����������ʽ��Ag���ϼ۽��ͣ�N���ϼ����ߣ�H���ϼ۽��ͣ��õ�2molAg����ת��4mol����˷�Ӧÿ����1 mol Agת�Ƶ��ӵ����ʵ���Ϊ2mol���ʴ�Ϊ��2mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϡ�����Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN����ͼ��ʾ��
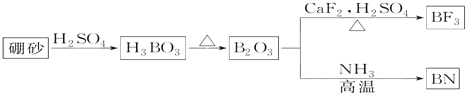
��ش��������⣺
��1����B2O3�Ʊ�BF3��BN�Ļ�ѧ����ʽ��___��___��
��2����̬Bԭ�ӵĵ����Ų�ʽΪ___��B��N��ȣ��ǽ����Խ�ǿ����___��BN��BԪ�صĻ��ϼ�Ϊ___��
��3����BF3�����У�F��B��F�ļ�����___���÷���Ϊ___���ӣ���д�������� �����Ǽ���������BF3����NaF���ÿ�����NaBF4��BF4-�п��ܺ���___������ṹΪ___��
��4������ʯī�ṹ���Ƶ��������������У�����Bԭ����Nԭ��֮��Ļ�ѧ��Ϊ___�����������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ó�Ϊ�����о����ȵ㣬�����͵���з�����Ҫ�IJ��ϡ�
(1)ͨ�����·�Ӧ�Ʊ���������
��ӦI�� Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ��H1=akJ��mol-1
��Ӧ��Al2O3(s)+3C(s) =2Al(g)+3CO(g) ��H2=bkJ��mol-1
��Ӧ��3AlCl(g)=2Al(l)+AlCl3(g) ��H3
�ٷ�Ӧ��ġ�H3=____kJ/mol��
��950��ʱ��������(Al2O3)�������Ľ�̿��C12��Ӧ���Ƶ�AlCl3���÷�Ӧ�Ļ�ѧ����ʽ�� _____________________________
(2)�ڸ��������½��з�Ӧ��2Al(l)+AlCl3 (g)![]() 3AlCl(g)
3AlCl(g)
����ͼ1��ʾ����ʼ�ݻ���ȵ������ܱ�����A��B�м���������Al�ۣ��ٷֱ����1molAICl3 (g)������ͬ�ĸ����½��з�Ӧ��ͼ2��ʾA�����ڵ�AlC13(g)���������ʱ��ı仯ͼ����ͼ2�л��� B������AlCl3 (g)���������ʱ��ı仯����____________��
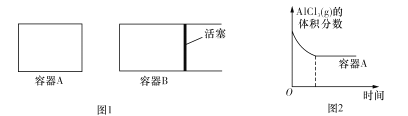
��1 100��ʱ����2L�ܱ�������ͨ��3mol AlCl(g)��������Ӧ��3AlCl(g)![]() 2Al(l)+AlCl3 (g)����֪���¶���AlCl(g)��ƽ��ת����Ϊ80%����÷�Ӧ��ƽ�ⳣ��K= ___���ڷ�Ӧ�ﵽƽ����ټ���1molAlCl(g)�����´ﵽƽ��ʱAlCl(g)��ƽ��ת���ʽ� ___���������С�����䡱����
2Al(l)+AlCl3 (g)����֪���¶���AlCl(g)��ƽ��ת����Ϊ80%����÷�Ӧ��ƽ�ⳣ��K= ___���ڷ�Ӧ�ﵽƽ����ټ���1molAlCl(g)�����´ﵽƽ��ʱAlCl(g)��ƽ��ת���ʽ� ___���������С�����䡱����
�ۼ���3 mol AlCl(g)���ڲ�ͬѹǿ�·�����Ӧ���¶ȶԲ��ʵ�Ӱ����ͼ3��ʾ����˷�Ӧѡ���¶�Ϊ _____________________
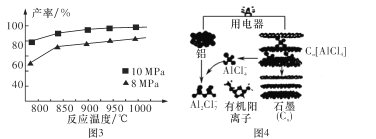
(3)�����������������ٷŵ������Ӷ��ε�أ��õ���Խ�������ʯīΪ�缫����AlCl4-��Al2Cl2-���л���������ɵ������Һ���乤��ԭ����ͼ4��ʾ��
�ٸõ�طŵ�ʱ��AlCl4-�� ___������缫����ʯī�缫���������ƶ���
�ڸõ�س��ʱ�������ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ð���������ֱ�Ӻϳɰ�����ͨ������ת�������Ʊ�����:
![]()
��1������������Ϊ����ɫ�������____���ѧʽ����
��2��NH3����ˮ������Һ��___�������������� ������������������ ����
��3����ƽNO2��HNO3�Ļ�ѧ����ʽ��3NO2 +H2O = ___HNO3 + NO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(B)���仯�����ڻ�ѧ��ҵ���������;����ش��������⣺
��1�����⻯��(NaBH4)�������Ҫ�����
��NaBH4��BԪ�صĻ��ϼ�Ϊ___��
![]() ��ҵ�Ͽ������������[B(OCH3)3]���⻯��(NaH)��Ӧ�Ʊ�NaBH4����Ӧ����һ�ֲ���Ϊ�״���(CH3ONa)���÷�Ӧ�Ļ�ѧ����ʽΪ___��NaBH4��ˮ��Ӧ����NaBO2��H2���÷�Ӧ���ɵ����������뻹ԭ��������ʵ���֮��Ϊ___��
��ҵ�Ͽ������������[B(OCH3)3]���⻯��(NaH)��Ӧ�Ʊ�NaBH4����Ӧ����һ�ֲ���Ϊ�״���(CH3ONa)���÷�Ӧ�Ļ�ѧ����ʽΪ___��NaBH4��ˮ��Ӧ����NaBO2��H2���÷�Ӧ���ɵ����������뻹ԭ��������ʵ���֮��Ϊ___��
��2����ҵ���������(��Ҫ�ɷ�ΪMg2B2O5��H2O����������Fe2O3��FeO��CaO��Al2O3��SiO2��)Ϊԭ���Ʊ�����B�Ĺ���������ͼ��ʾ��
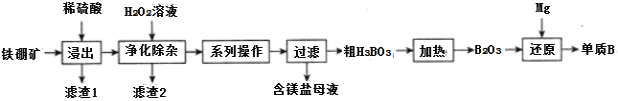
��֪��
�������� | Fe3+ | Al3+ |
��ʼ������PH | 2.7 | 3.1 |
������ȫ��PH | 3.7 | 4.9 |
![]() ��������ʱ���������ʯ�����Ŀ��Ϊ___��
��������ʱ���������ʯ�����Ŀ��Ϊ___��
![]() ����1����Ҫ�ɷ�Ϊ___��
����1����Ҫ�ɷ�Ϊ___��
![]() ������������ʱ���ȼ�H2O2��Һ����Ŀ��Ϊ___��Ȼ���ٵ�����Һ��pH��5.0��Ŀ����___��
������������ʱ���ȼ�H2O2��Һ����Ŀ��Ϊ___��Ȼ���ٵ�����Һ��pH��5.0��Ŀ����___��
![]() �ƵõĴ�����һ��������������BI3��BI3���ȷֽ���Եõ������ĵ������ֽ�0.025g�����Ƴɵ�BI3��ȫ�ֽ⣬���ɵ�I2��0.30mol��L-1Na2S2O3��Һ�ζ�(I2+2S2O32-=2I-+S4O62-)���յ㣬����18.00mLNa2S2O3��Һ��ʢװNa2S2O3��ҺӦ��___(������ʽ��������ʽ��)�ζ��ܣ��ô�����Ʒ�Ĵ���Ϊ___��
�ƵõĴ�����һ��������������BI3��BI3���ȷֽ���Եõ������ĵ������ֽ�0.025g�����Ƴɵ�BI3��ȫ�ֽ⣬���ɵ�I2��0.30mol��L-1Na2S2O3��Һ�ζ�(I2+2S2O32-=2I-+S4O62-)���յ㣬����18.00mLNa2S2O3��Һ��ʢװNa2S2O3��ҺӦ��___(������ʽ��������ʽ��)�ζ��ܣ��ô�����Ʒ�Ĵ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������Ԫ���⣬���е�ÿ����Ŵ���һ��Ԫ�ء������Ҫ��ش����⣺
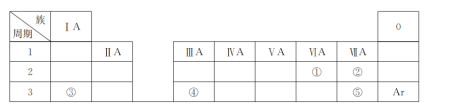
(1)�ٵ�Ԫ�ط�����________��
(2)�ں͢ݵ�ԭ�Ӱ뾶��С��ϵ�Ǣ�________��(����������������������)��
(3)�ۺ͢��γɵĻ����ﺬ�еĻ�ѧ����__________(�������Ӽ����������ۼ���)��
(4)�ۡ��ܵ�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�����;�dz��㷺,����ú����Ȼ����Ϊԭ���������ش���������:
(1)��H2O(g)��O2����CH4�ƺϳ������Ȼ�ѧ����ʽ����:
(ˮ��������)CH4(g)+ H2O(g)=CO(g)+3H2(g) H=+ 206 kJ��mol -1
(��������)CH4(g)+0.5O2(g)=CO(g)+2H2(g) H=-36 kJ��mol-1
��2H2(g)+O2(g)=2H2O(g)�� H=_______kJ��mol-1��
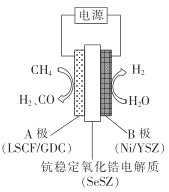
��Ϊ�˱�����ƽ��,ͬʱ�����ַ�ʽ����,������������ʧ,�����ϵõ��ĺϳ�����n(CO): n(H2)=1 :____(������λС��)��
����ˮ����������������װ����ͼ��װ�ù���ʱ,O2-��_____(����A"����B��)��Ǩ��;���������ĵ缫��ӦΪ___________��
(2)��̿��ˮ�����ں����ܱ������з�Ӧ�ƺϳ�������Ҫ��Ӧ( I )��(II )��lgKp(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��)��T�Ĺ�ϵ����ͼ��ʾ��
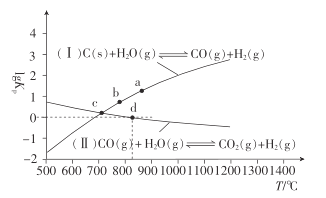
�ٷ�Ӧ(II)��H_____(����������������������С����)0��
���������ѹǿ:a��_____ (�������������� ��������С����)b��,������_________��
��c��ʱ,��ӦC(s) +CO2(g)![]() 2CO(g)��Kp=_____ (����ֵ)��
2CO(g)��Kp=_____ (����ֵ)��
���ں����ܱ������г���0. 5 mol CO��2 mol H2O(g)ֻ������Ӧ(II),ͼ��d�㴦�ﵽƽ��ʱ,CO��ת����Ϊ_______;�ﵽƽ��ʱ,���������ٳ���0.5 mol CO��2 mol H2O(g),���´ﵽƽ��ʱ,CO��ƽ��ת����_______(��������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
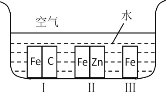
����Ŀ��(1)��ͼ��ʾ���������������������ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳����(�����)_______________��
(2)���ȴ�����һ�����ƻ�����������ʡ��ڴ���ƽ�����У����ȴ����������ߵ�����ֽ����ԭ�ӣ���ԭ�Ӳ��������йط�Ӧ����Cl+O3��ClO+O2 ��O3��O+O2 ��ClO+O��Cl+O2�����еķ�Ӧ���ܷ�Ӧʽ��_________���������ȴ������ƻ�����������ԭ����______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com