
下列属于正确的水解离子方程式的是( )
|
| A. | NH4++H2O⇌NH3•H2O+H+ | B. | H2O+H2O⇌H3O++OH﹣ |
|
| C. | CO32﹣+2H2O⇌H2CO3+2OH﹣ | D. | Fe3++3H2O⇌Fe(OH)3↓+3H+ |
考点:
盐类水解的原理;离子方程式的书写.
专题:
盐类的水解专题.
分析:
根据盐类方程式的书写规则判断.
盐类水解方程式的书写规则为:
1、盐类水解一般很微弱,要写“⇌”,产物不标“↓”或“↑”.
2、多元弱酸盐的水解是分步进行的且一步比一步难,因此,水解方程式要分步写.
3、多数弱碱阳离子也是分步水解的,但一般以总反应式表示.
解答:
解:A、该方程式符合书写规则,故A正确.
B、该方程式是电离方程式,故B错误.
C、多元弱酸盐的水解是分步进行,故C错误.
D、盐类水解一般很微弱,产物不标“↓”,故D错误.
故选A
点评:
盐类水解方程式的书写规则为:
1、盐类水解一般很微弱,要写“⇌”,产物不标“↓”或“↑”.
2、多元弱酸盐的水解是分步进行的且一步比一步难,因此,水解方程式要分步写.
3、多数弱碱阳离子也是分步水解的,但一般以总反应式表示.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
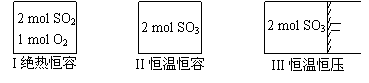

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.SO3的体积分数:II>III
D.容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
|
| A. | 4v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 2v(NH3)=3v(H2O) | D. | 4v(O2)=5v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是( )
|
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 |
|
| C. | 物质B的质量分数增加了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述中,正确的是( )
|
| A. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(1)△H=+57.3kJ/mol |
|
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ |
|
| D. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀硫酸和稀盐酸的混合溶液100mL中,加入固体Ba(OH)24.275g,充分反应后,测得溶液的pH为13(设溶液体积不变),再经过滤得干燥沉淀物2.33g.求原溶液中SO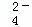 、Cl﹣、H+的物质的量浓度分别是多少?
、Cl﹣、H+的物质的量浓度分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl2.现将214.5gCa(ClO)2放入500 mL 12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L.试计算:
(1)该反应消耗的氧化剂的质量是 g
(2)若反应前后溶液的体积保持不变,则反应后溶液中HCl的物质的量浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com