
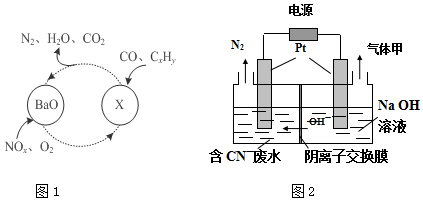
分析 (1)根据化合价降低为氧化剂被还原判断;氮的氧化物与BaO结合生成Ba(NO3)2;
根据NOx与NH3的直接反应,实现无害转化,则生成氮气和水,据此书写方程式;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(3)①根据次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl结合得失电子守恒配平方程式;
②根据反应的离子方程式进行计算;
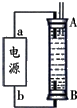
(4)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,右边为阴极为氢离子得电子生成氢气的反应,据此分析.
解答 解:(1)在图1所示的转化中N、O化合价降低为氧化剂被还原;氮的氧化物与BaO结合生成Ba(NO3)2,所以X为Ba(NO3)2;因为NOx与NH3的直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的量之比为4:1时,发生反应的化学方程式为8NH3+8NO+2NO2=9N2+12H2O;
故答案为:N、O;Ba(NO3)2;8NH3+8NO+2NO2=9N2+12H2O;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317.0 kJ•mol-1,
故答案为:-2317.0 kJ•mol-1;
(3)①因为次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,
故答案为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O;
②由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.448L即$\frac{0.448L}{22.4L/mol}$=0.02mol N2(标准状况),则需消耗浓度为0.5mol•L-1的次氯酸钠的体积为$\frac{0.02×3}{0.5}$×1000ml=120ml,
故答案为:120;
(4)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,又溶液成碱性,所以反应式为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O;右边为阴极为氢离子得电子生成氢气的反应,所以甲为氢气,
故答案为:H2;2CN-+12OH--10e-=2CO32-+N2↑+6H2O.
点评 本题考查了氧化还原反应、盖斯定律的应用、电解池的原理的应用,题目难度中等,明确盖斯定律的应用方法以及从化合价的角度分析氧化还原反应是解题的关键,侧重于考查学生的分析能力、计算能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 同温、同压下,相同体积的氮气和氦气所含的原子数相等 | |
| B. | 标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA | |
| C. | 1 mol氯气和足量NaOH溶液反应转移的电子数为2NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com