
相同温度下,下列溶液导电性最强的是( )
|
| A. | 1L0.1mol/L醋酸 | B. | 2L0.1mol/L亚硫酸溶液 |
|
| C. | 0.1L 0.1mol/L硫酸溶液 | D. | 0.5L 0.1mol/L盐酸 |
考点:
电解质溶液的导电性.
专题:
电离平衡与溶液的pH专题.
分析:
溶液导电性强弱取决于溶液中离子浓度大小;醋酸、亚硫酸使弱酸,硫酸和盐酸是强酸,同浓度溶液强电解质导电能力大于弱电解质溶液
解答:
解:A、1L0.1mol/L醋酸,醋酸是弱电解质存在电离平衡;溶液中离子浓度小于0.2mol/l;
B、2L0.1mol/L亚硫酸溶液,亚硫酸是中强酸,存在电离平衡;溶液中离子浓度小于0.3mol/L;
C、0.1L 0.1mol/L硫酸溶液,硫酸是强电解质完全电离,溶液中离子浓度等于0.3mol/l;
D、0.5L 0.1mol/L盐酸溶液中,氯化氢是强电解质完全电离,溶液中离子浓度等于0.2mol/l,
比较以上数据可知C最大,
故选C.
点评:
本题考查了电解质溶液的导电性强弱判断,主要考查溶液中离子浓度大小的分析判断和计算,区分强电解质、弱电解质是解题关键,题目较简单.


科目:高中化学 来源: 题型:
在一定条件下,发生CO+NO2⇌CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
|
| A. | 正反应为吸热反应 | B. | 正反应为放热反应 |
|
| C. | 降温后CO的浓度增大 | D. | 降温后各物质的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
14CO2与碳在高温条件下发生反应:14CO2+C⇌2CO,达到平衡后,平衡混合物中含14C的粒子有( )
|
| A. | 14CO2 | B. | 14CO2、14CO |
|
| C. | 14CO2、14CO、14C | D. | 14CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
对某一可逆反应来说,使用催化剂的作用是( )
|
| A. | 提高反应物的平衡转化率 |
|
| B. | 以同样程度改变正逆反应的速率 |
|
| C. | 增大正反应速率,减小逆反应速率 |
|
| D. | 改变平衡混合物的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列能源符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
|
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示温度、压强对下列平衡的影响:N2 (g)+3H2(g)⇌2NH3(g)△H<0图中y轴表示的意义是( )
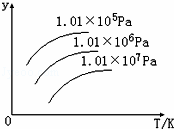
|
| A. | 正反应速率 |
|
| B. | 平衡混合气体中NH3的含量 |
|
| C. | 平衡混合气体中N2的物质的量 |
|
| D. | H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从某废触媒[主要成分为活性炭、ZnO、FeO、(CH3COO)2Zn]中制取醋酸锌晶体的实验步骤如图:
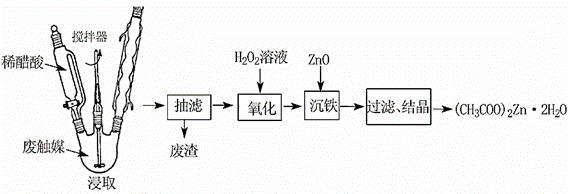
(1)浸取时,在三口烧瓶中加入废触媒及稀醋酸,给三口烧瓶加热并同时开动搅拌器的目的是 。
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是 。抽滤时用的硅酸盐质仪器有 和 。
(3)流程图中加入H2O2的目的是 。
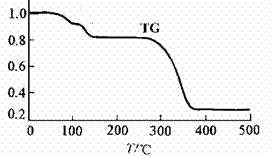
(4)所得晶体(CH3COO)2Zn·2H2O热重分析(TG/%=固体样品的剩余质量/固体样品的起始质量),文献表明分解分三个阶段,在200℃以下脱去两分子结晶水,形成的(CH3COO)2Zn在242℃熔融,370℃完全分解为ZnO同时生成CO2及一种含氧衍生物(核磁共振氢谱只有1组峰)。(CH3COO)2Zn分解生成氧化锌的反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com