
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
分析 A、不能利用酸性氧化物的溶解性来比较酸性;
B、根据溶液中发生的强酸制取弱酸的原理来分析;
C、反应是在高温下固体之间的反应;
D、根据溶液中发生的强酸制取弱酸的原理及盐酸易挥发来分析.
解答 解:A、酸性氧化物与对应酸的酸性强弱没有关系,则无法比较酸性,故A错误;
B、因往硅酸盐溶液通入二氧化碳,可以看到溶液变浑浊,是因为生成了难溶的硅酸沉淀,反应方程式是:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应原理是强酸制弱酸,说明碳酸比硅酸酸性强,故B正确;
C、比较强酸制取弱酸时在溶液中进行的反应,则在高温下固体之间的反应不能得到酸性强弱的结论,故C错误;
D、氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀,根据强酸制弱酸,只能说明盐酸的酸性比碳酸强,氯化氢通入可溶性硅酸盐溶液中生成沉淀,为盐酸与硅酸盐的反应,说明盐酸酸性比硅酸强,但无法确定碳酸与硅酸的酸性的强弱,故D错误;
故选B.
点评 题目考查了物质性质,根据强酸制弱酸原理,必须在溶液中发生的化学反应,因此C选项,不能得出硅酸的酸性比碳酸强,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 白磷为正四面体分子 | 白磷分子中P-P-P的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
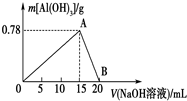 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L | B. | 1.25mol/L | C. | 2.5mol/L | D. | 3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com