
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
分析 Ⅰ.滴定时,氢氧化钠溶液放在碱式滴定管中,待测液放在锥形瓶中;
Ⅱ.分析图表数据结合醋酸和氢氧化钠按照1:1反应计算样品溶液浓度,依据浓度计算样品总酸量.
解答 解:Ⅰ.(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中,故答案为:锥形瓶;
(3)氢氧化钠可腐蚀玻璃塞,应放在碱式滴定管中,故答案为:碱式滴定管;
Ⅱ.依据实验数据结合反应CH3COOH+NaOH=CH3COONa+H2O,实验4误差较大,可舍去,
实验1、2、3平均消耗氢氧化钠溶液体积=$\frac{14.98+15.00+15.02}{3}$=15.00ml;
c(样品)×V(样品)=c(NaOH)×V(NaOH)
c(样品)×20.00ml=0.1000mol/L×15.00ml
c(样品)=0.75mol/L;
样品总酸量g/100mL=$\frac{0.75mol×60g/mol}{1000ml}$=4.5g/100ml,
故答案为:0.75mo/L;4.5.
点评 本题考查物质的含量的测定,为高频考点和常见题型,题目侧重考查酸碱中和滴定实验的操作步骤和计算应用,注意把握终点判断,指示剂的选择,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
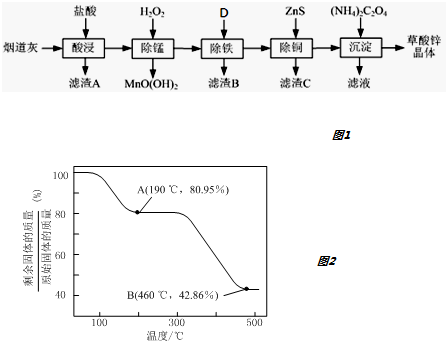
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
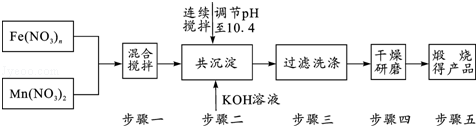
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥⑦ | B. | 只有①③⑤⑦ | C. | 只有③④⑥ | D. | 只有①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤④① | C. | ⑤①②③④ | D. | ⑤③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com