
下列有关物质的性质与应用不相对应的是 ( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的酚酞试纸放在试管口
C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CO2过量时,CO2与NaOH反应生成NaHCO3(CO2+NaOH=NaHCO3)。参照物质的溶解度,用NaOH(固)、CaCO3(固)、水、盐酸为原料制取33 g纯NaHCO3。
| 25℃ | NaHCO3 | Na2CO3 | NaOH |
| 溶解度/g | 9 | 33 | 110 |
(1)若用100 g水,则制取时需用NaOH g。
(2)若用17.86 g NaOH(固),则需用水 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关亚硫酸的下列叙述中不正确的是( )
A.亚硫酸是SO2的水溶液,显酸性
B.SO3溶于水,剧烈反应生成亚硫酸
C.亚硫酸具有漂白性,能够使品红溶液褪色
D.亚硫酸不稳定,易分解为水和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正
确的是
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分 为CuFeS2)冶炼铜的主要流程如下:
为CuFeS2)冶炼铜的主要流程如下:
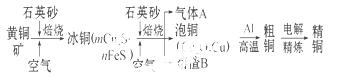
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(2)用稀硫酸浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),
检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c. 溶液中Cu2+向阳极移动
溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后, 还剩余2 mL无色气体,则原混合气体中O2的体积是 ( )
还剩余2 mL无色气体,则原混合气体中O2的体积是 ( )
A.1.2 mL  B.2.4 mL
B.2.4 mL
C.3.6 mL D.4.8 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
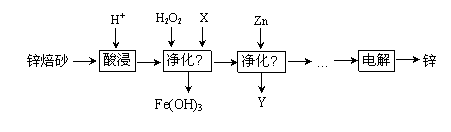

(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
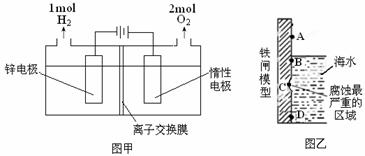
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有 [Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
己二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
 +8HNO3
+8HNO3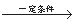 3HOOC(CH2)4COOH+8NO
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
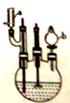
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(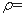 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50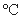 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(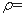 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90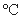 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___________________。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com