
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
分析 A.只含共价键的化合物是共价化合物;
B.铵盐是由非金属元素构成的离子化合物;
C.水分子间存在氢键,沸点较高;
D.元素周期表的金属与非金属的分界线处的元素具有金属和非金属的性质.
解答 解:A.具有共价键的化合物可能是离子化合物,如KOH,故A错误;
B.铵盐是离子化合物,铵盐是由非金属元素构成的离子化合物,故B错误;
C.水分子间存在氢键,沸点较高,所以H2O比H2S的沸点高,与共价键强弱无关,故C错误;
D.元素周期表的金属与非金属的分界线处的元素具有金属和非金属的性质,具有半导体性质,故D正确;
故选D.
点评 本题考查了化合物和化学键的关系,明确物质中含有的化学键再结合基本概念来分析解答,会利用举例法分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 40s | B. | 15s | C. | 30s | D. | 20s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
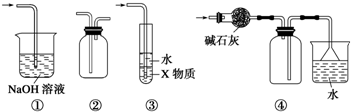
| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3-甲基-1-丁烯.
3-甲基-1-丁烯.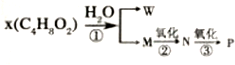
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

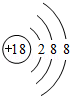
| A. | 一个小黑点表示1个自由运动的电子 | |
| B. | 1s轨道的电子云形状为圆形的面 | |
| C. | 电子在1s轨道上运动像地球围绕太阳旋转 | |
| D. | 1s轨道电子云图中小黑点的疏密表示电子在某一位置出现机会的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 | |
| C. | 配位键在形成时,是由成键双方各提供一个电子形成共用电子 | |
| D. | 三种不同的非金属元素可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com