
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
分析 氯化铁和氢氧化钠反应生成红褐色沉淀氢氧化铁,Fe3++3OH-=Fe(OH)3↓,存在溶解沉淀平衡,Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),结合平衡移动的影响因素解答该题.
解答 解:A.氯化铁和氢氧化钠反应生成红褐色沉淀氢氧化铁,Fe3++3OH-=Fe(OH)3↓,故A正确;
B.存在氢氧化铁溶解沉淀平衡,一定含有铁离子,故B错误;
C.氢氧化铁溶解于盐酸溶液中,Fe(OH)3+3H+=Fe3++3H2O,铁离子浓度增大,故C错误;
D.沉淀形成在溶液中存在溶解沉淀平衡,Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),故D正确.
故选BC.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重考查学生的分析能力,注意把握沉淀的生成和性质,把握影响溶解平衡的影响因素,难度不大.


科目:高中化学 来源: 题型:实验题
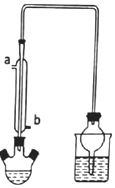 溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).
溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质粒子的大小不同 |
| B | 除去Na2CO3中的NaHCO3 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B元素形成的一系列化合物中,其中A元素质量分数的最大值为25% | |
| B. | 四种元素中电负性最大的是B | |
| C. | C所形成的气态氢化物,在其同主族元素的气态氢化物中沸点最低 | |
| D. | 四种元素中第一电离能最小的是D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
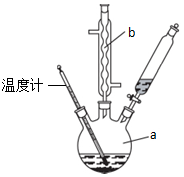 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,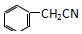 +2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4
+2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4 ,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.
,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com