
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL,则4个容器中气体的质量由大到小的顺序是( )
|
| A. | a>b>c>d | B. | b>a>d>c | C. | c>d>b>a | D. | d>c>a>b |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)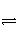
 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
A.等于p% B.大于p% C.小于p% D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)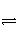
 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应的是( )
|
| A. | 2F2+2H2O=4HF+O2↑ | B. | 2Na+2H2O=2NaOH+H2↑ |
|
| C. | CaO+H2O=Ca(OH)2 | D. | Cl2+H2O=Hcl+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:
VmLAl2(SO4)3溶液中含Al3﹣ag,取 mL溶液加水稀释到10VmL,则稀释后溶液中SO42﹣的物质的量浓度是( )
mL溶液加水稀释到10VmL,则稀释后溶液中SO42﹣的物质的量浓度是( )
|
| A. |
| B. |
|
|
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要配制500mL 0.2mol/L NaOH 溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有 (填字母)
A.烧杯B.容量瓶C.漏斗D.胶头滴管E.玻璃棒
(2)用托盘天平称取NaOH固体,其质量为 .
(3)下列操作步骤的正确顺序是 (填序号)
①称取一定质量的NaOH固体,放入烧杯中,用适量蒸馏水溶解;
②加蒸馏水至液面距容量瓶颈刻度线下1﹣2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转入500mL容量瓶中;
④盖好瓶盖,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转入容量瓶中.
(4)若称量时耗时过长,会使配制出的NaOH溶液的物质的量浓度 (填“偏高”、“偏低”或“不变”,下同);若缺少步骤⑤,会使配制出的NaOH溶液的物质的量浓度 ,若步骤ƒ未冷却至室温就转移至容量瓶中定容,会使配制出的NaOH溶液的物质的量浓度 ;若转移时容量瓶中已有少量蒸馏水,会使配制出的NaOH溶液的物质的量浓度 ;若定容时仰视,会使配制出的NaOH溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
| 示意图 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液的说法正确的是( )
A. Na2SO3溶液加水稀释后,pH和KW均减小
B. 0.1mol•L﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C. 浓度分别为0.2mol•L﹣1和0.1mol•L﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D. 室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com