
分析 (1)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素;
(2)同一主族中,元素的电负性随着原子序数的增大而减小;
(3)离子晶体离子半径越小,电荷数越多,晶格能越大;
(4)均为离子晶体,MgO中镁离子半径小于钙离子半径,离子键强;
(5)同元素含氧酸的非羟基氧数目越多,酸性越强酸;
(6)镁型:配位数12、空间利用率74%,钾型:配位数8、空间利用率68%.
解答 解:(1)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素,C和N都属于第2周期,同周期N第一电离能N大于C,故答案为:<;
(2)同一主族中,元素的电负性随着原子序数的增大而减小,故电负性Cl>Br,故答案为:>;
(3)离子晶体离子半径越小,电荷数越多,晶格能越大,钾离子半径小于铯离子,晶格能KCl>CsCl,故答案为:>;
(4)均为离子晶体,MgO中镁离子半径小于钙离子半径,离子键强,则硬度:MgO>CaO,故答案为:>;
(5)同元素含氧酸的非羟基氧数目越多,酸性越强酸,HClO3非羟基氧数目为2,HClO为0,故酸性HClO3>HClO,故答案为:>;
(6)镁型:配位数12、空间利用率74%,钾型:配位数8、空间利用率68%,故答案为:>.
点评 本题考查较综合,根据元素周期律来分析解答即可,难度不大,注意第一电离能的规律及异常现象,为易错点.


科目:高中化学 来源: 题型:解答题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
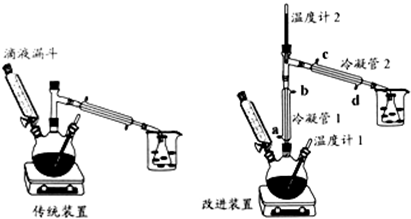
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量低的电子只能在s轨道上运动,能量高的电子总在f轨道上运动 | |
| B. | 电子的运动和行星相似,围绕着原子核在固定的轨道上高速旋转 | |
| C. | 同一能层中不同能级的能量高低相同 | |
| D. | M能层中含有3d能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{135}$I位于元素周期表中第4周期ⅦA族 | |
| B. | ⅦA族氢化物的沸点:HF<HCl<HBr<HI | |
| C. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 | |
| D. | ${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的两种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:X>Z>W | |
| C. | 最高价氧化物的水化物的酸性:W>Z | |
| D. | X可分别与W、Y形成化合物,其所含的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 铝片与浓硫酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附着在试管内壁上的AgOH固体可用氨水溶解而洗去 | |
| B. | 可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 | |
| C. | 向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 | |
| D. | 加热碘单质,产生紫色蒸气,这个过程克服了范德华力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com