
下列关系的表述中,正确的是
A.0.1mol· L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
D.0.1mol· L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列溶液中,物质的量浓度最大的是( )
A.1 L H2SO4溶液中含98 g H2SO4 B.0.5 L含49 g H2SO4的溶液
C.98 g H2SO4溶于水配成2 L溶液 D.0.1 L含24.5 g H2SO4的溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
已知反应mX(g)+nY(g) qZ(g) △H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是
qZ(g) △H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是
A.通入稀有气体使压强增大,平衡不移动
B.增大压强同时又升高温度,反应速率加快且可以提高Z的产率
C.降低温度,混合气体的平均相对分子质量变大
D.增加X的物质的量,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:填空题
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因______________,其溶液中离子浓度大小顺序为________________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除④⑦⑧外,若其余5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为:_________________(填序号)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述,正确的是
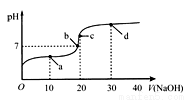
A.a点时:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,7 | B. | 2,8 | C. | 3,7 | D. | 3,8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
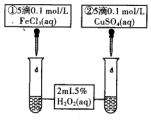 取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2-2e-═2H+ | B. | 2H++2e-═H2 | C. | Fe2++2e-═Fe | D. | 2Ag++2e-═2Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com