Ag
2O
2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO
3溶液,生成Ag
2O沉淀,保持反应温度为80℃,边搅拌边将一定量K
2S
2O
8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为:
2AgNO
3+4KOH+K
2S
2O
8 Ag
2O
2↓+2KNO
3+K
2SO
4+2H
2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag
2O
2 转化为Ag,负极的Zn转化为K
2Zn(OH)
4,请写出相关反应方程式:正极
Ag2O2+4e-+2H2O=2Ag+4OH-
Ag2O2+4e-+2H2O=2Ag+4OH-
,负极
2Zn-4e-+8OH-=2Zn(OH)42-
2Zn-4e-+8OH-=2Zn(OH)42-
,总反应式
Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
.
(3)反应过程中,溶液里OH
-将向
负极
负极
在“正极”、“负极”中选择)移动,正极c(OH
-)将
增大
增大
(在“增大”,“减小”,“不变”中选择)
(4)准确称取上述制备的样品(设仅含Ag
2O
2和Ag
2O)2.588g,在一定的条件下完全分解为Ag 和O
2,得到224.0mLO
2(标准状况下).计算样品中Ag
2O
2的质量分数(计算结果精确到小数点后两位).

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):

 5N2+6H2O
5N2+6H2O 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+

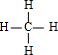
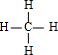
 +3H2
+3H2
 +3H2
+3H2