
氯的原子序数为3517Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g35Cl2气体的体积约为1.12L
D.35Cl2气体的摩尔质量为70
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站。某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
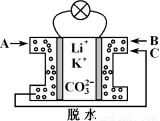
A.Li+、K+移向左侧电极
B.外电路中电子由右侧电极移向左侧电极
C.通入1 mol气体A时,左侧电极上生成5 mol CO2
D.相同条件下通入气体B与气体C的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y 乙酸乙酯,下列说法不正确的是
乙酸乙酯,下列说法不正确的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯
C.乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种
D.Y分子中含有3种不同环境的氢,峰面积比为3:2:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质氧化性的强弱 B.单质沸点的高低
C.单质与氢气化合的难易 D.最高价氧化物对应的水化物酸性的强弱
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
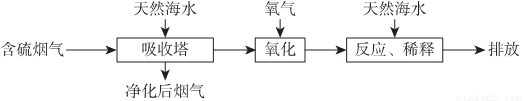
下列说法错误的是
A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
消除氮氧化物和硫氧化物有助于预防雾霾天气的形成。
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)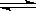 N2(g)+CO2(g)△H。维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
N2(g)+CO2(g)△H。维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
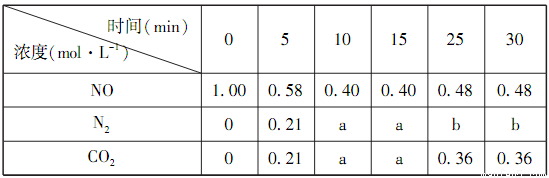
①0~10min内,NO的平均反应速率v(NO)=___________,该温度下反应的平衡常数K=___________。
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=___________,改变的条件可能是___________。
A.加入一定量的活性炭
B.通入一定量的N2
C.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H___________0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为___________。
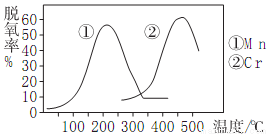
②右图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是___________。
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=___________(已知Ksp(CaSO3)=1.4×10-7)。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:实验题
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
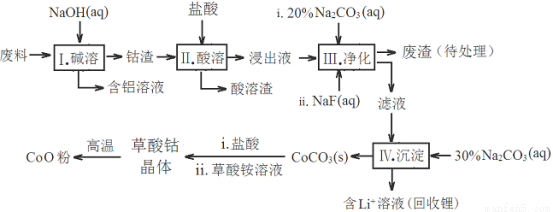
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是____________________________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式_________________________
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有______________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___________。
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_________________。
(6)某锂离子电池的总反应为C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
X、Y是元素周期表第VIIA族的两种元素,下列说法中能说明X的非金属性比Y强的是( )
A.X元素原子的电子层数比Y元素原子的电子层数多
B、X的气态氢化物比Y的气态氢化物稳定
C、X的最高价氧化物对应水化物的酸性比Y的弱
D、Y的单质能将X从NaX溶液中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com