
 已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G.
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G. .
.分析 B为淡黄色化合物,B与H反应能生成D,且D为气体单质,则B为Na2O2,D为O2,H为H2O或CO2;A为固体单质,A能够发生反应生成Na2O2,则A为金属Na;Na和过氧化钠都能够转化成C,则C为NaOH;J为固体单质,J能够转化成H,则J为C,又H与I含有完全相同的元素,则H为CO2,I为CO;E为常见金属氧化物、⑤F的溶液和H反应生成白色胶状沉淀G,则F为NaAlO2,G为Al(OH)3,E为Al2O3,电解融融的E(Al2O3)可得铝和氧气,据此进行解答.
解答 解:B为淡黄色化合物,B与H反应能生成D,且D为气体单质,则B为Na2O2,D为O2,H为H2O或CO2;A为固体单质,A能够发生反应生成Na2O2,则A为金属Na;Na和过氧化钠都能够转化成C,则C为NaOH;J为固体单质,J能够转化成H,则J为C,又H与I含有完全相同的元素,则H为CO2,I为CO;E为常见金属氧化物、⑤F的溶液和H反应生成白色胶状沉淀G,则F为NaAlO2,G为Al(OH)3,E为Al2O3,电解融融的E(Al2O3)可得铝和氧气,
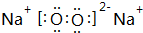
(1)B为Na2O2,过氧化钠为离子化合物,其电子式为 ,
,
故答案为: ;
;
(2)B为过氧化钠,H为二氧化碳,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)向偏铝酸钠的水溶液中通入少量二氧化碳生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)E为氧化铝,电解融融的氧化铝可以获得铝和氧气,反应的化学方程式为:2Al2O3(融融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;100g氧气的物质的量为:$\frac{100g}{32g/mol}$=3.125mol,根据电子守恒,生成3.125mol氧气转移的电子的物质的量为:3.125mol×4=12.5mol,所以转移的电子数为12.5NA,
故答案为:2Al2O3(融融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;12.5NA;
(5)若测得1g固体单质J与一定量的气体H恰好完全反应生成气态I时吸收的热量为Q kJ,J为C,H为二氧化碳,I为CO,1g C的物质的量为:$\frac{1g}{12g/mol}$=$\frac{1}{12}$mol,则1molC完全反应吸收的热量为12QkJ,故该反应的热化学方程式为:C(s)+CO2(g)═2CO(g)△H=+12Q kJ•mol-1,
故答案为:C(s)+CO2(g)═2CO(g)△H=+12Q kJ•mol-1.
点评 本题考查无机物的推断,题目难度中等,“B为淡黄色固体、A、J为固体单质,D为气体单质”等为解答本题的突破口,熟悉物质的性质及相互转化推断物质为解答本题的关键,侧重Na、C、Al元素单质及其化合物性质的考查,试题充分培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
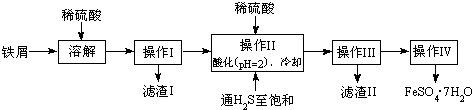
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只存在离子键 | |
| B. | 非金属元素组成的化合物中可能存在离子键 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性共价键 | |
| D. | 含金属元素的化合物中一定存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 醋酸浓度/mol•L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4mol | B. | 18.4mol•L-1 | C. | 20.4 | D. | 20.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )
一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )| A. | 1:1 | B. | 8:1 | C. | 4:1 | D. | 5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com